Анемический синдром в онкологии
Анемия нередко осложняет течение различных новообразований. До 40 % больных со злокачественными лимфомами и более половины больных с множественной миеломой уже к моменту постановки диагноза имеют выраженную анемизацию. У 1/4 больных с миеломой содержание гемоглобина не превышает 80 г/л, а количество больных с анемией среди больных с лимфомами по окончании лечения увеличивается до 70 %. Считается, что эта проблема менее значима при солидных опухолях.
Тем не менее анализ данных донорских регистров США свидетельствует, что до 50— 60 % больных с опухолями гинекологической сферы, мочеполовых органов и легкого получали заместительные гемотрансфузии в период проведения химиотерапии.
Более половины из 7000 больных с анемией, включенных в контролируемые популяционные исследования по применению эритропоэтина у больных с неоплазиями, имели солидные опухоли.
В 2001 г. проведено проспективное изучение частоты анемии у больных с опухолевыми заболеваниями в Европе (ECAS). Содержание гемоглобина было сниженным у 31 % первичных больных, не получавших лечения, и у 42 % больных, которым проводили химио- или радиотерапию.
Если у больных не было анемии на момент постановки диагноза, то в большинстве случаев (62 %) она развивалась в процессе лечения. Анемия возникала у 63 % больных, получавших химиотерапию (у 75 % после режимов, содержащих препараты платины, и у 54 % после прочих), у 42 % больных после сочетанного применения химио- и радиотерапии и у 20 % больных только после лучевого воздействия. Лишь 40 % больных с анемией, выявленной исходно или на протяжении лечения, получали заместительные гемотрансфузии или эритропоэтин.
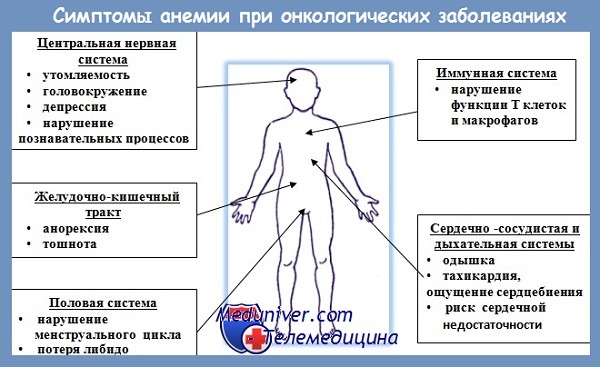
При опухолевых заболеваниях патогенез анемии многообразен. Основные причины — кровотечение, дефицит витаминов и железа, аутоиммунный гемолиз, метастазирование в костный мозг, токсичность цитостатиков и др. Анемия нередко развивается у больных, не имеющих для этого видимых причин.
При исследовании качества жизни больных с опухолевыми заболеваниями слабость выделена как одна из наиболее распространенных жалоб. В частности, слабость осложняет проведение химиотерапии у 76 % больных, тошнота — у 54 % и боль у 24 % больных. В генезе слабости могут играть роль такие факторы, как нарушение нейромышечной проводимости, повышение уровня метаболизма белков, снижение питания и аффективные расстройства (депрессия). В то же время при многовариантном статистическом анализе одним из самых значимых независимых прогностических факторов слабости была анемия. Современные данные свидетельствуют о появлении слабости, снижающей показатели качества жизни, при содержании гемоглобина менее 120 г/л. В контролируемых исследованиях по лечению анемии максимальное снижение слабости и прирост показателей качества жизни наблюдались при повышении содержания гемоглобина до 120 г/л.
Слабость, снижение физической и социальной активности часто недооцениваются врачами, которые не склонны считать эти проблемы важными по сравнению с болью, рвотой или инфекцией. В современных работах по выявлению значимости основных жалоб больных с опухолевыми заболеваниями слабость и социальная дезадаптация занимают лидирующее место. В одном из исследований на вопрос, что следует лечить в первую очередь: слабость или боль, большинство больных выбрали слабость. На тот же самый вопрос 95 % врачей ответили противоположным образом.
Анемия и как следствие тканевая гипоксия могут сказаться на эффективности лекарственного и лучевого противоопухолевого лечения. Противоопухолевый эффект радиации связан с образованием свободных радикалов, которые взаимодействуют с основаниями ДНК в присутствии молекулярного кислорода, что останавливает клеточную пролиферацию и вызывает гибель клеток. Недостаток кислорода замедляет этот процесс. В клетке, находящейся в состоянии гипоксии, свободные радикалы не фиксируются к ДНК и мембранам и, таким образом, смерть клетки может не наступить. Впервые снижение эффекта облучения при гипоксии описал врач из Вены Готвальд Шварц в 1909 г.. Он обратил внимание на то, что при наложении на кожу радиоактивной пластины лучевая реакция непосредственно под ней значительно снижена.
Исследователь объяснил свое наблюдение тем, что сдавление сосудов под тяжестью радиоаппликатора вызывает анемизацию подлежащей области и снижает эффект облучения. В последующем эта гипотеза была подтверждена в эксперименте с облучением культур бактерий, находящихся в гипоксическом состоянии, и в клинических наблюдениях. Так, в исследовании D. М. Brizel непосредственная эффективность радиотерапии и долговременная выживаемость больных с опухолями головы и шеи были в 2 раза ниже при напряжении кислорода в опухоли менее 10 мм рт. ст.. Было отмечено, что гипоксическое состояние опухоли коррелировало с содержанием гемоглобина в крови. В других исследованиях показано, что ткани опухоли находятся в более гипоксическом состоянии, чем окружающие нормальные ткани.
Обычно гипоксия опухоли возникает в тот момент, когда ее рост превышает способность локальной микрососудистой сети доставлять достаточное количество кислорода к опухолевым клеткам.
Оксигенация опухоли в основном определяется объемом кровотока, степенью развитости микроциркуляции и содержанием гемоглобина; таким образом, снижение количества гемоглобина крови может ухудшить оксигенацию опухоли.
Изучали влияние собственно анемии на чувствительность опухоли к радиотерапии. В одном из ретроспективных исследований прослежена долговременная выживаемость 889 больных с чешуйчато-клеточным раком головы и шеи, получавших радиотерапию. Пятилетняя выживаемость мужчин с содержанием гемоглобина более 130 г/л и женщин более 120 г/л составила 58,2 %, что контрастировало с уровнем этого показателя (28,4 %) для больных, у которых содержание гемоглобина оказалось ниже.
На модели фибросаркомы у мышей на опухолевые клетки, находящиеся в состоянии гипо- и нормоксии, воздействовали различными цитотоксичными препаратами. Оказалось, что клетки, находящиеся в состоянии гипоксии, были в 2—6 раз более резистентными к таким цитостатикам, как циклофосфамид, кармустин (BCNU), карбоплатин и мелфалан, чем опухолевые клетки, находящиеся в состоянии нормальной оксигенации. Клиническая значимость этих наблюдений неясна, однако данные, полученные в последние годы у больных раком шейки матки, подтверждают концепцию о способности гипоксии индуцировать селекцию клеток, резистентных к апоптозу, и то, что данный механизм определяет злокачественную прогрессию опухоли.

Анемия представляет собой патологическое состояние, для которого характерно снижение эритроцитов и/или концентрации гемоглобина в единице объема крови. Анемия не является самостоятельным заболеванием, это симптом, который характерен для самых разнообразных заболеваний, в том числе и для злокачественных опухолей.
Согласно статистике, данное состояние выявляется у каждого третьего онкологического пациента, а при прохождении химиотерапии — более чем в 90% случаев. Опасность анемии в онкологии заключается в том, что вместе с уменьшением уровня гемоглобина и эритроцитов, уменьшается и кислородная емкость крови. Этот фактор неблагоприятно сказывается на течении ракового процесса, снижает эффективность лечения и ухудшает дальнейший прогноз.
- Основные причины развития анемии у онкологических пациентов
- Как выявить анемию
- Как классифицируется анемия
- Методы лечения анемии
- Лечение анемии народными способами
Основные причины развития анемии у онкологических пациентов
Снижение уровня эритроцитов и гемоглобина может развиваться вследствие снижения их образования, ускоренного разрушения или в результате потери. Каждой из этих причин способствуют собственные факторы, которые рассмотрим подробнее:
- Недостаточная выработка форменных элементов крови и гемоглобина может развиваться при поражении костного мозга, недостатке железа в организме или некоторых витаминов (фолиевая кислота, витамин В12). Данные состояния могут быть напрямую связаны с напрямую с онкологическим заболеванием. Например, потеря железа может развиваться в результате постоянной рвоты, отсутствия аппетита и нарушения его всасывания в кишечнике, который поражен опухолевым процессом. Некоторые виды препаратов, которые назначают при злокачественных опухолях, подавляют рост не только раковых клеток, но и клеток крови, которые активно делятся. Также анемия может развиваться при непосредственном поражении костного мозга опухолевым процессом.
- Ускоренное разрушение эритроцитов отмечается при воздействии различных лекарственных препаратов и при аномальной активности иммунной системы. Разрушение эритроцитов непосредственно в сосудах называется внутрисосудистым гемолизом. Этот процесс протекает в норме после завершения жизненного цикла эритроцитов, который составляет 120 дней. Однако при воздействии различных факторов (прием антибиотиков, цитостатиков, присоединение вторичной инфекции и др.), этот срок значительно уменьшается, что и приводит к развитию анемии.
- Кровопотеря у онкологических пациентов может быть как острой, так и хронической. Первый вариант встречается при проведении хирургического лечения рака, а также при развитии внутренних кровотечений, которые являются частым осложнением основного заболевания. Развитие анемии при хронической кровопотере отмечается в тех случаях, когда имеется скрытый источник незначительного кровотечения. Например, при колоректальном раке кровь может выделяться с калом незаметно для пациента.
Установление точной причины анемии играет решающее значение при выборе метода лечения. Кроме того, врач учитывает степень тяжести, тип анемии, общее состояние пациента и другие параметры. Получить эту информацию можно на диагностическом этапе.
Как выявить анемию
Обследование традиционно начинается с опроса пациента и сбора анамнеза. Врач должен помнить, что не всегда анемия развивается вследствие основного заболевания. Возможны наследственные или любые другие причины, которые не связаны с опухолевым процессом. Также необходимо установить вид предшествующего противоопухолевого лечения, продолжительность и количество курсов, наименование препаратов, которые применялись. На следующем этапе врач проводит общий осмотр. Анемия может проявляться бледностью кожных покровов, слабостью, потерей аппетита, головокружением и другими симптомами. Очень часто эти проявления отмечаются при различных видах рака, который протекает без анемии, поэтому поставить диагноз исходя только из жалоб пациента невозможно.
Объективную информацию можно получить только при помощи лабораторных исследований. Анемия диагностируется по следующим анализам:
- Количество ретикулоцитов.
- Уровень железа сыворотки крови.
- Уровень белка трансферрина и ферритина.
- Уровень витамина В12 и фолиевой кислоты.
Отдельное внимание уделяется общему анализу крови. В нем определяется уровень гемоглобина, количество эритроцитов и гематокрит (отношение форменных элементов к жидкой составляющей крови). Также определяют средний объем эритроцита, среднее содержание гемоглобина в эритроците и среднее содержание гемоглобина во всей эритроцитарной массе.
При необходимости в программу комплексного обследования при анемии могут включаться и другие лабораторные анализы или специальные методы.
Как классифицируется анемия
В зависимости от значения цветового показателя, степени тяжести и механизма развития, анемия разделяется на несколько категорий. Цветовой показатель крови отражает степень насыщения эритроцитов гемоглобином. Его значение в норме колеблется от 0,85 до 1,05 единиц. Снижение показателя отмечается при гипохромной анемии, а повышение — при гиперхромной. Если цветовой показатель в норме, но уровень гемоглобина все равно низкий, то говорят о нормохромной анемии.
По степени тяжести, анемия разделяется на три группы, в зависимости от концентрации гемоглобина:
- При легкой степени анемии уровень гемоглобина не опускается ниже отметки в 90 г/л.
- При средней степени анемии показатель колеблется в пределах 90-70 г/л.
- Тяжелая анемия характеризуется падением гемоглобина ниже 70 г/л.
Классификация анемии по механизму развития наиболее обширна. Среди распространенных форм отмечаются:
- Железодефицитная анемия. Развивается в результате нарушения всасывания, усиленной потери или недостаточного поступления железа в организм.
- Гемолитическая анемия. Характеризуется разрушением эритроцитов в сосудистом русле или за его пределами. Наиболее частые причины — недостаточность специфических ферментов, аутоиммунные заболевания, воздействие лекарственных препаратов.
- Постгеморрагическая анемия. Данное состояние характерно для острой или хронической кровопотери
- Апластическая анемия. Характеризуется снижением уровня клеток-предшественников эритроцитов в костном мозге. Обычно отмечается снижение и других форменных элементов — тромбоцитов и лейкоцитов.
- В12-дефицитная анемия. При недостатке витамина В12 нарушается процесс образования эритроцитов, снижается их продолжительность жизни. Дефицит витамина может быть связан как с нарушением его всасывания в кишечнике, так и с недостаточным поступлением в организм.
В большинстве случаев определить точный вид анемии можно после нескольких лабораторных тестов, но иногда приходится применять более сложные методы диагностики, например, генетическое исследование. Понимание механизма развития анемии и получение максимально полной информации об изменениях в показателях крови являются важным компонентом эффективной терапии данного симптома.
Методы лечения анемии
Устранить анемию у онкологических пациентов можно тремя способами: переливание эритроцитарной массы, введение эритропоэтина, назначение препаратов, содержащих железо. В отдельных случаях может применяться комбинация этих методов.
Переливание эритроцитарной массы является самым действенным методом, при помощи которого можно быстро восполнить дефицит эритроцитов, восстановить уровень гемоглобина и гематокрита. Однако без устранения причины анемии, этот способ даст лишь временный эффект. Поэтому переливание эритроцитарной массы не является альтернативой другим методикам и применяется только при наличии показаний. Одним из них является снижение уровня гемоглобина ниже 90 г/л. Переливание проводят при развитии у пациента характерных признаков анемии, среди которых отмечаются:
- Головокружение.
- Потеря сознания.
- Тахикардия.
- Быстрая утомляемость.
- Боль в груди.
- Одышка.
Данный метод лечения анемии также может применяться у пациентов, которые прошли курс химиотерапии или лучевой терапии и у которых отмечается быстрое снижение уровня гемоглобина или эритроцитов.
Стимуляторы эритропоэза при анемии увеличивают концентрацию гемоглобина и эритроцитов за счет усиления их образования в костном мозге. При сочетании с гемотрансфузиями, данный метод показывает очень хорошие результаты, но при этом имеет и ряд недостатков, которые касаются осложнений. В частности, применение стимуляторов эритропоэза для лечения анемии повышает риск развития тромботических осложнений, который и так является высоким у онкологических пациентов. По данным, полученным в ходе нескольких научных исследований, этот риск увеличивается в 1.4-1.7 раз.
В последнее время обсуждается вопрос о влиянии стимуляторов эритропоэза на выживаемость онкологических пациентов. В частности, специалисты установили, что применение препаратов данной группы при лечении анемии у пациентов с распространенным опухолевым процессом головы и шеи, шейки матки, молочной железы и других диагнозах снижает продолжительность жизни на 10-17%. В связи с этим специалисты предлагают придерживаться следующих правил:
- Если уровень гемоглобина составляет менее 100 г/л и пациент при этом проходит лечение химиопрепаратами, то стимуляторы эритропоэза могут назначаться с целью коррекции анемии и профилактики дальнейшего снижения показателей.
- Если уровень гемоглобина падает до 100 г/л и ниже, но химиотерапия при этом не проводится, то применять стимуляторы эритропоэза не рекомендуется ввиду повышенного риска развития осложнений и снижения продолжительности жизни.
- Во всех остальных случаях применять стимуляторы эритропоэза для лечения анемии у онкологических пациентов следует с осторожностью.
Также на протяжении всего времени лечения важно контролировать динамику лабораторных показателей и при увеличении уровня гемоглобина постепенно снижать дозировку стимуляторов эритропоэза.
Препараты железа применяются с целью лечения железодефицитных анемий, которые выявляются у 30-60% онкологический больных. При этом снижение уровня железа может быть связано как с самим опухолевым процессом или проводимым лечением, так и с другими факторами. Например, при назначении стимуляторов эритропоэза, существующего запаса железа в организме становится недостаточно для того, чтобы покрыть потребность, которая возникает в результате активного синтеза гемоглобина в костном мозге.

Для лечения анемии могут применяться как внутривенные, так и пероральные препараты. Второй вариант более удобен для пациента, так как таблетки проще принимать, но при этом данная форма действует медленнее и чаще приводит к осложнениям со стороны ЖКТ. Внутривенное введение позволяет добиться быстрого эффекта, что актуально при проведении химиотерапии.
Таким образом, для лечения анемии современная онкология может предложить различные методы, которые воздействуют на механизмы развития данного симптома. Точный план терапии подбирается индивидуально для каждого пациента, с учетом лабораторных показателей крови, особенностей лечения основного заболевания и других параметров.
Лечение анемии народными способами
Некоторые пациенты по разным причинам отказываются от приема описанных выше препаратов и обращаются к народной медицине. Безусловно, некоторые растения или продукты могут оказывать стимулирующее действие на систему кроветворения. Однако, учитывая основной диагноз и тяжесть анемии, этого действия крайне недостаточно для восстановления уровня гемоглобина и кислородной функции крови. В результате снижается эффективность противоопухолевого лечения, ухудшается прогноз и существенно повышается риск неблагоприятного исхода. Устранить выраженную анемию в домашних условиях при помощи народных методов невозможно. Этим должны заниматься врачи соответствующего профиля, в распоряжении которых имеются современные лекарственные препараты.
Эта форма клинического течения названа так ввиду наличия симптомокомплекса общих расстройств в организме больного. Среди начальных клинических проявлений у больных, входящих в разбираемую группу, выступают такие симптомы, как недомогание, слабость, быстрая утомляемость, потеря сил и работоспособности, повышение температуры, бледность кожных покровов и развитие прогрессирующей анемии. Бледность покровов с развитием заболевания постепенно нарастает; цвет лица больного приобретает землистый оттенок. В таких случаях общее состояние и внешний вид больного указывают на наличие тяжелого заболевания.^Нарастание симптомов общих расстройств, наличие длительного субфебрилитета, прогрессирова-ние анемии вызывают подозрение у врача на септическое состояние, эндокардит или заболевание крови типа пернициоз-ной гипохромной анемии. С подозрением на всевозможные другие заболевания такие больные нередко длительно находятся на обследовании в лечебных учреждениях, но мысль о наличии злокачественной опухоли толстой кишки обычно высказывается с большим опозданием.
Весьма демонстративным в этом отношении является следующее наблюдение.
Больной О., 54 лет (история болезни №1396), переведен в хирургическую клинику 4/VIII 1953 г. из терапевтической клиники. Больным себя считает с осени 1952 г., когда впервые появились головные боли, головокружение, общая слабость, быстрая утомляемость и понижение трудоспособности. В январе 1953 г. при оформлении посылочного листа на курорт была ВЫЯВЛЕНА анемия (гемоглобин — 33%). Госпитализирован в терапевтическое отделение заводской больницы, где находился на протяжении 2 месяцев с диагнозом гипохромной анемии. Лечился переливанием консервированной крови, введением камполона, препаратов мышьяка, витаминов, но, несмотря на это. гемоглобин не поднимался выше 35%. В связи с ухудшением общего состояния с марта по апрель находился на лечении в терапевтической клинике. Отмечалось ухудшение состояния, нарастание общей слабости, усиление головных болей и головокружение. За последние три месяца он потерял в весе 6 кг, резко понизился аппетит, появились тошноты и периодические приступообразные боли в животе. Приступы болей стали теперь почти ежедневными. Боли держатся 2—3 мин и самостоятельно проходят. При обследовании в заводской больнице и терапевтической клинике изменений со стороны внутренних органов выявлено не было. Были произведены многочисленные анализы желудочного и дуоденального содержимого, анализы мочи, анализы крови анализы кала на содержание яиц глистов. Изменения выявлены только со стороны крови. Анализ крови: НЬ от 25 до 36%, эр. от 2700000 до 3 100000, цветной показатель—от 0,5 до 0,7, л. от 6200 до 8100. Лейкоцитарная формула: базофилы от 0,5 до 1%, э, от 11,5% до 17,6%, п. от 3 до 5%, с. от 35,5 до 41,2%, лимф. от 21 до 39%, мои. от 4 до 8,5%, РОЭ от 30 до 40 мм в час. Выраженный анизо-пойкилоцитоз. Гипохромия. Много лейкоцитов с разорванными ядрами. Нормобласты 2 : 200. Биохимические анализы крови на содержание сахара с нагрузкой и без нагрузки, на общий белок и белковые фракции, остаточный азот, холестерин и желчные пигменты не выявили отклонений от нормы.
При трехкратном рентгенологическом обследовании жслудочно-кишечного тракта ограничились введением контрастной массы через рот. При такой методике рентгеноскопии изменений со стороны желудочно-кишечного тракта обнаружено не было. Исследований толстой кишки посредством контрастной клизмы и анализов кала на скрытую кровь произведено не было.
В мае 1953 г. больной находился на обследовании и лечении в институте в гор. Ялте. С подозрением на опухоль почки подвергся тщательному урологическому обследованию, но изменений со стороны почек обнаружено не было. В четвертый раз в институте было произведено рентгенологическое обследование желудочно-кишечного тракта, которое ограничилось осмотром пищевода, желудка, двенадцатиперстной кишки и верхних отделов тонкой кишки. Обследование толстой кишки и анализ кала на скрытую кровь произведены не были.
В июле 1953 года, через 9 месяцев от начала заболевания и через 7 месяцев после почти непрерывного нахождения в лечебных учреждениях, больной поступил в другую терапевтическую клинику. В этой клинике больному произведена ирригоскопия толстой кишки и обнаружен дефект наполнения размером 5Х6 см, циркулярно суживающий просвет восходящей кишки с перестройкой рельефа слизистой по типу ракового поражения. В нескольких анализах кала на скрытую кровь реакция оказалась положительной. Диагноз рака восходящей кишки подтвержден на операции и гистологическими исследованиями послеоперационного препарата. Больному произведена правосторонняя гемиколэктомия с хорошими непосредственными и отдаленными результатами. Больной в настоящее время жив и считает себя здоровым.
Приведенное наблюдение характеризует симптомокомплекс начальных клинических проявлений токсико-анемической формы рака восходящей кишки. С развитием заболевания отмечается нарастание других клинических симптомов и, в частности, появление тошнот и периодических приступообразных болей в животе. Несмотря на нарастание тяжести заболевания и выраженности симптомов токсико-анемической формы, характер заболевания длительное время оставался нераспознанным. Запоздалое распознавание объясняется ошибочной оценкой к.ш-нического симптомокомплекса со стороны врачей и отсутствием
целенаправленного полноценного обследования. Приведенная история болезни указывает на медленное течение токсико-анемической формы рака толстой кишки и на возможность проведения радикального оперативного вмешательства даже при выраженных клинических формах с благоприятным исходом.

Группы классификаций анемии
Анемия делится на 6 видов в зависимости от причины и условий ее возникновения.
Возникает после потери крупного количества крови (от 500 мл и больше). Дефицит железа, кислорода, работоспособность сосудов падает.
- травма или операция,
- язва желудка и/или двенадцатиперстной кишки,
- заболевания крови, печени, легких,
- внематочная беременность.
- регулярная кровопотеря (обильные месячные, кровотечения при геморрое, носовые или ушные кровотечения),
- гастриты, воспаления желудочно-кишечного тракта,
- беременность,
- инфекции, отравление.

Врожденное заболевание, чаще всего наследственное.
Связано уже не с дефицитом количества эритроцитов, а с дефицитом его содержания. То есть уменьшается величина, форма, окраска, ядро. При этом в крови накапливается свободное железо, то есть железо, которое никак не задействовано в важных процессах организма.
При сидероахрестическом заболевании долгое время анемия практически не проявляется, возможны лишь легкие, почти незаметные симптомы. Но с дальнейшим развитием увеличиваются органы: печень, селезенка.
Из-за недостатка фолиевых кислот и витамина B12 из-за нарушения работы ЖКТ, когда в слизистой оболочке плохо вырабатывается гликопротеин (либо не вырабатывается вообще).
Гликопротеин – группа белков отвечающая за распознавание бактерий, вирусов; влияющая на углеводные процессы, а главное – осуществляющая перенос железа по крови.
Мегалобластная анемия чаще всего бывает у пожилых людей, у тех, кто перенес рак желудка, воспаление в тонком кишечнике (энтерит), гепатит.
При данном заболевании стремительно разрушаются эритроциты, повышается объем свободного гемоглобина. ГА может быть наследственной или приобретенной. Проявляется в виде типичного анемического синдрома: утомляемость, шум в ушах, сонливость, затрудненное дыхание, бледность. При запущенной форме – желтуха, увеличенная селезенка, искривление лицевых костей.
Вызвана дефицитом клеток костного мозга и элементов крови: тромбоцитов, эритроцитов и лейкоцитов. На это влияют химические вещества (например, бензол, свинец) или медикаменты (левомицетин). Сопровождается тем же комплексом симптомов, что при гемолитической анемии: быстрая утомляемость, сонливость, шум в ушах, одышка, бледность слизистых.
Посмотрите большое видео про анемический синдром
Особенности симптомов
В развитии рака ободочной кишки выделяют шесть клинических форм. Каждой из них соответствуют определенные симптомы заболевания.
- Токсико-анемический синдром более характерен для поражения восходящего отдела. Преобладает интоксикация, нарастающая анемия, повышение температуры тела.
- Началом энтероколитической формы являются кишечные расстройства, что проявляется чередованием запоров и поносов, метеоризмом. Нарушение моторики может закончиться кишечной непроходимостью. Чаще наблюдаются при локализации опухоли в нисходящем отделе.
- Обтурационная форма проявляется симптомами прогрессирующей кишечной непроходимости в нисходящем отделе.
- Диспепсическая форма с признаками дискомфорта, появлением кишечных расстройств характерна для опухоли в поперечно-ободочном либо восходящем отделе, реже – в нисходящем отделе. При этом снижается аппетит, появляется отрыжка, а иногда и рвота, чувство тяжести в верхней части живота.
- Псевдовоспалительная форма является проявлением осложненного рака с гнойно-воспалительным процессом.
- Опухолевая или атипичная форма. Клиника наличия опухоли преобладает над другими признаками, поэтому обнаруживают опухоль случайно при пальпации брюшной полости.
Болевой синдром может носить тупой либо ноющий характер, а иногда это сильные нестерпимые боли приступообразного характера. Боль в животе является начальным признаком при расположении опухоли в восходящем отделе оболочной кишки. При локализации опухоли в нисходящем отделе боль связана с кишечной непроходимостью.
Выделение крови с калом, слизи, гноя свидетельствует о наличии рака в дистальном отделе ободочной кишки — сигмовидной кишке.
Осложнения при раке ободочной кишки типичные, но преобладает кишечная непроходимость. Метастазирование может происходить лимфогенным путем в регионарные лимфатические узлы, гематогенным, имплантационным путем – прорастание опухоли в венозную сеть либо в стенки кишки.
Рак необходимо дифференцировать с другими заболеваниями самой кишки, а также с заболеваниями смежных с ней органов. Проводят колоноскопию кишечника и другие исследования.
Системная диагностика
При диагностике анемии учитывается 2 главных фактора: общий анализ крови и определение причины анемии. В первом случае можно установить вид анемии, во втором – ее источник.
Для диагностики вида малокровия прибегают к нескольким исследованиям крови:
- развернутый анализ;
- анализ на наличие ретикулоцитов (молодые эритроциты) и лейкоцитов (белые кровяные клетки);
- биопсия костного мозга;
- изучение содержания железа и ферритина (белок, выполняющий роль депо для железа) в кровяной сыворотке.
| Категория | Норма гемоглобина в г/л | Предел и ниже нормы |
| Мужчины | 130–170 | 130 |
| Женщины | 120–150 | 120 |
| Беременные | 110–150 | 110 |
| Дети 1–6 лет | 110–150 | 110 |
| Дети 7–12 лет | 115–150 | 115 |
| Подростки | 115–155 | 115 |
Первая часть ДД выявляет механизм, причину, спровоцировавшую дефицит гемоглобина, а вторая подразумевает исследование самого процесса снижения гемоглобина. Иным словами, выясняется категория анемии и ее причина.
Здесь исследование уже зависит от проверки конкретного вида малокровия. Например, основываясь на первом этапе исследования, специалист предположил, что у пациента гемолитическая анемия. Тогда он прибегают к следующим действиям:
- — определение устойчивости эритроцитов к растворам;
- — определение в крови и моче объема желчи;
- — прямая проба Кумбса (анализ крови на выявление в ней опасных антител).
Лечение рака ободочной кишки
Лечение рака с локализацией в ободочной кишке проводят хирургическим путем. Операция может быть радикальной: одномоментной, двух и трехэтапной, а также комбинированной. Возможно проведение паллиативной операции.
- Химиотерапия
- Лучевое лечение практически не применяется ввиду подвижности ободочной кишки, небольшой толщины стенок, опасности их перфорации.
Отдаленный прогноз наиболее благоприятен при первой стадии заболевания. От стадии к стадии этот показатель заметно снижается: при третьей стадии 5-ти летняя выживаемость составляет всего 30 %.
Лечение АС назначают в зависимости от его причины, вида анемии, степени тяжести, а также возраста и положения больного (беременность, лактация) после комплексной диагностики.
Почти всегда план схема включает устранение источника малокровия, а после – выравнивание уровня гемоглобина.
Существуют базовые варианты лечения:
- Диета. Больному нужно придерживаться специального сбалансированного питания с достаточным количеством белков, железа и витаминов.
- Назначение кроветворных препаратов: таблетки, инъекции внутривенно и внутримышечно. Последний способ менее популярен, так как возможны аллергические реакции.
- При мегалобластной анемии назначаются подкожные уколы цианокобаламина (препарат с витамином В12, из-за нехватки которого возникает МА) около 1-1,5 месяцев. Позже витамины принимаются для профилактики.
- Во время медикаментозного лечения врач должен наблюдать и фиксировать эффективность препаратов по уровню ретикулоцитов в крови больного. Этот этап во всех случаях занимает не меньше месяца, когда в случае успеха число ретикулоцитов повышается уже на второй неделе после начала приема, а потом при необходимости добавляют лекарства с фолиевой кислотой либо с другим дефицитным элементом.
Обычно это в тех случаях, когда уровень гемоглобина ниже 40-50 г/л или есть угроза жизни пациента. Тогда назначаются следующие процедуры:
- переливание крови;
- пересадка красного костного мозга;
- гормонотерапия;
- назначение специальных экстрактов печени (пищевая добавка из животных органов в виде порошка или жидкости).
Специальная диета при анемии подразумевает исключение вредных продуктов и включение полезных, а в некоторых случаях – дробное питание для более легкого и быстрого усвоения.
Нужно полностью убрать из меню жирные продукты и полуфабрикаты, соленое, копченое, острое, снэки, алкоголь, суррогатные напитки вроде порошковых соков, энергетики. Все это мешает крови сворачиваться.
Не стоит употреблять продукты, богатые кальцием, так как он мешает всасыванию железа.
Запрещены блюда с рассолом и уксусом молоко, выпечка, черный чай, кофе, кока-кола (кофеин и сахар мешают усвоению железа).
В список ограничений попадает еда с оксалатами — вещества, которые блокируют молекулы железа.
Что включить в меню?
Диетическое меню при анемии при этом очень разнообразно. Так, оно включает продукты с витамином С, который помогает усвоить нужные кроветворные элементы. Больному прописаны цитрусовые (кроме мандаринов), киви.
Обязательно в рационе должны быть белки – как минимум 120-140 грамм в день. Это нежирные сорта мяса: красное мясо, печень, птица, морепродукты; также домашний творог, тофу.
Ежедневно нужно съедать свежие фрукты и овощи, зелень, крупы (гречка, овсянка, пшено, чечевица, ячмень), сухофрукты. На десерт можно позволить себе темный мед.
Каждые 2-3 часа нужно выпивать по 200-300 мл воды (не менее 2 литров в день). Выработать такую привычку больной может с помощью мобильных приложений. Они напоминают о том, когда нужно выпить, ведут учет выпитого и т.д.
Врачи также советуют слабоминерализованную железосульфатно-гидрокарбонатномагниевую воду, способствующую всасыванию железа. Чем больше жидкости, тем лучше. При ее недостатке кровь сгущается, а это блокирует кроветворные элементы и мешает поступлению кислорода.
Примерное диетическое меню при анемии
- 1-й завтрак: 2 яйца всмятку, овсяная каша с фруктами, свежевыжатый сок.
- 2-й завтрак: 150 г нежирного творога, печеные овощи, отвар шиповника.
- Обед: горсть ягод, овощи на пару, печень, компот из фруктов.
- Полдник: яблоко, салат из помидоров и огурцов с зеленью.
- Ужин: тушеная говядина, брокколи, чай с медом.
У каждого больного анемией есть индивидуальный план медикаментозного лечения.
Препараты железа
При начальных стадиях АС допускается лечение методами народной медицины. Например, специальные настойки, восстанавливающие кроветворные процессы: настой крапивы, череды, плодов и листьев лесной земляники, плодов шиповника, листьев шпината, медуницы, одуванчика.
Для остановки кровотечения пациентам прописывают отвары пастушьей сумки, корневищ кровохлебки, хвоща полевого, листьев барбариса, водяного перца.
Лечение анемии у беременных включает сбалансированный рацион с богатыми железом и белками продуктами: мясо, печень и рыба, сырые овощи и фрукты, гречневая каша.
В программу входят безопасные для плода железосодержащие препараты. Их назначают в индивидуальном порядке. Как правило, в виде таблеток или драже с различными кислотами: аскорбиновая, янтарная, фолиевая, фруктозу, цистеин. Они помогают железу лучше всасываться.
Лечение длится как минимум 2-3 месяца, но гемоглобин восполняется уже со второй недели. После 3-го месяца будущая мать продолжает принимать препараты, но в меньших дозах.
Группы риска и распространенность
Риску заболеть анемией подвержены следующие категории людей:
- недоношенные младенцы
- дети на искусственном вскармливании
- подростки
- женщины с обильными менструациями
- беременные
- женщины в период лактации
- люди с заболеваниями ЖКТ.
Дети относятся к одной из самых распространенных групп с анемией. Их можно разделить на:
- новорожденных;
- детей до 3-х лет;
- подростков;
- дети, у которых анемию спровоцировали другие заболевания.
Недоношенные младенцы имеют дефицит кровяных элементов из-за того, что недополучили их в положенный срок: во время развития в течение 9 месяцев им поступает необходимое из организма матери. Это время высокого потребления железа, когда формируются кроветворные процессы плода.
Анемический синдром одновременно проявляется у женщины, находящейся в положении, так как ее организм питает необходимыми элементами не только ее, но и будущего ребенка. Двойной расход требует больших ресурсов.
Кормящие матери находятся в такой же зоне риска. Только что родившийся ребенок должен адаптироваться к новой среде, укрепиться в ней, начинается бурное развитие его организма, его рост. Кроветворные ресурсы играют здесь важную роль, поэтому младенец активно пополняет их из материнского молока: в нем железо находится в легкоусвояемой форме. Двойной расход сохраняется.
У подростков железо и гемоглобин наиболее активно расходуется в период пубертата. Нехватка микроэлементов особенно острая у девочек в первый год прихода менструаций. Аналогичная проблема и у женщин с обильными менструациями.
Отдельная категория – люди с болезнями желудка и кишечника. Через ЖКТ идет усвоение и поступление в кровь важных веществ, но больная и слабая система неспособна выполнять это полноценно: нарушенный кислотный баланс не дает железу всасываться, а диета больного включает в рацион питания мало железосодержащих продуктов.
Симптомы и признаки анемического синдрома в запущенной стадии
При нехватке железа сердце вынуждено работать больше для перекачивания крови, чтобы подавать кислород в нужном количестве. Органу тяжело справляться с постоянной нагрузкой, что отражается на общем состоянии.
При гемолитической анемии в запущенной стадии более выраженные симптомы, так как эритроциты разрушаются сильнее и быстрее:
- желтые белки глаз, пожелтевшая кожа;
- моча с коричневым или красноватым окрасом;
- язвы на ногах;
- боли в животе;
- почечная недостаточность;
- синяки.
Мегалообластная анемия сопровождается слабой умственной деятельностью: больной часто не может решить простые задачи или увидеть элементарный ответ в ребусе. Иногда чувствуется покалывание в руках и ногах, теряется обоняние. Походка становится неровной, движения – скованными.
Профилактика
Для профилактики анемического синдрома нужно придерживаться того же питания, что прописано больным малокровием.
Необходимы осмотры у терапевта, гематолога и гастроэнтеролога. Особенно тем, кто находится в группе риска: вегетарианцам, пожилым, беременным, кормящим матерям, женщинам с обильными месячными, а также людям, больным хроническими и острыми заболеваниями
Следует много времени проводить на свежем воздухе, регулярно проветривать жилые помещения, при любой возможности совершать пешие прогулки.
Анемия не так безобидна, как кажется на первый взгляд. Она может быть как причиной, так и следствием заболевания, негативно влияя на общее состояние и функцию отдельных органов. Если постоянно игнорировать симптомы, болезнь может принять серьезный оборот.
Читайте также:

