Андрогенная депривация при раке простаты что это

Гормонотерапия при раке простаты
Гормонотерапия при раке простаты
Более 12% всех злокачественных опухолевых заболеваний у мужчин занимает рак предстательной железы (РПЖ), а после 70 лет процент заболевших значительно увеличивается и в среднем составляет до 1400 случаев на 100000. В 1977 году профессор А. Shelly был удостоен Нобелевской премии за исследовательские работы пептидных гормонов, которые дали возможность разработать эффективную методику терапии агонистами ЛГРГ для медикаментозной кастрации. На сегодняшний день гормонотерапия при раке простаты считается главным методом лечения болезни, который позволяет увеличивать показатель выживаемости.

Принцип действия гормональной терапии
Перерождение обыкновенных клеток предстательной железы происходит под воздействием тестостерона – мужского полового гормона, синтезируемого особыми клетками семенников и корой надпочечников, это продукт периферического метаболизма. Конкретный механизм возникновения патологии до сих пор до конца не изучен, но уже имеющиеся знания дают возможность рекомендовать довольно эффективные протоколы лечения.

Гормонотерапия уменьшает количество тестостерона и блокирует его физиологическое воздействие на мужские органы. Врачи назначают прием гормонов на основании имеющихся анализов обследования больного и только после получения его согласия. Курс терапии должен выполнить несколько задач.
- Уменьшить размеры предстательной железы. В результате заболевания ее объем увеличивается в несколько раз, в случае радиотерапии приходится облучать большую площадь и захватывать здоровые ткани. Чем меньше опухоль – тем точнее можно сфокусировать ионизирующий луч, тем незначительнее негативные последствия лучевой терапии.
- Заметно уменьшить боли, минимизировать количество приема анестетиков. Многие из них имеют противопоказания, вызывают нежелательные сопутствующие реакции. Уменьшение и локализация боли значительно повышает качество жизни больного.
- Сократить скорость роста раковых клеток – продлить длительность жизни пациентов даже на последних стадиях развития болезни.
Если гормональная терапия при раке простаты у больных вызывает резистентность, то принимаются специальные индивидуальные мероприятия для ее предотвращения.
Исследованием новых методов терапии онкологических патологий занимается огромное количество научных сотрудников в развитых странах мира, в результате появляются новые более эффективные методики.
Используемые варианты гормональной терапии
Длительные наблюдения доказали эффективность андрогенной депривации примерно у 90% пациентов, в том числе и на поздних стадиях патологии. В последние несколько лет медики получили подтверждение эффективности и в качестве дополнения к лучевому или хирургическому методам лечения. Такие данные стали причиной интереса науки к интермиттирующей терапии – альтернативным протоколам гормональной терапии. Основными вариантами гормональной терапии являются следующие направления:
- монотерапия антиандрогенами, антиандрогены + ингибиторы;
- медикаментозная кастрация, Flare блокада + медикаментозная кастрация;
- интермиттирующая андрогенная депривация;
- альфаредуктазы, комбинированная андрогенная депривация;
- триплетная лекарственная терапия.
Таблица. Гормонотерапия при диссеминированном раке молочной железы: эффективность различных методов (неподобранные больные) [цит. по C. Henderson, 1991]
| Вид терапии | Число больных | Эффективность (%) |
| Антиэстрогены (тамоксифен)* | 1269 | 32 (16-52) |
| Овариэктомия** | 3380 | 33 (21-41) |
| Прогестины (МПА, мегестрол)* | 3479 | 31 (9-67) |
| Ингибиторы ароматазы (аминоглютетимид)* | 1153 | 32 (16-43) |
| LH-RH аналоги (золадекс)** | 293 | 40 (32-45) |
| Эстрогены* | 1683 | 26 (15-38) |
| Андрогены* | 2250 | 21 (10-38) |
| Адреналэктомия* | 3739 | 32 (23-46) |
| Гипофизэктомия | 1174 | 36 (22-58) |
Цель гормональной терапии состоит в том, чтобы положительно воздействовать на раковые клетки после хирургического вмешательства. Во всех случаях выживаемость после сложных хирургических вмешательств увеличилась с 62% до 71%.
Используемые типы гормонотерапии
Протоколы лечения допускают возможность использовать три вида терапии гормонами, окончательное решение принимается лечащим врачом на основании анализа состояния больного. Во время приема могут вноситься изменения с учетом реакции организма пациента.
![]()
Аналоги ЛГРГ
К ним относятся леупрорелина ацетат, трипторелин, гозерелин и бусерелин. Препараты подавляют продукцию тестостерона, не излечивают РПЖ, но заметно улучшают симптоматику и задерживают прогрессирование развития онкологических клеток. Гормональное лечение рака предстательной железы повышает качество жизни, врачи имеют время для использования полного комплекса существующих методик с целью минимизации последствий заболевания.
После первого приема препаратов агонисты провоцируют временный выброс ЛГ, что становится причиной увеличения плазменного уровня тестостерона (так называемый эффект вспышки). В клинических условиях такие ситуации предупреждаются путем назначения антиандрогенов. Через 3–4 недели наблюдается снижение чувствительности гипофиза больного, как следствие – уменьшение вырабатываемых гормонов тестостерона. Благоприятный профиль побочных эффектов позволяет рекомендовать прием препарата на различных стадиях заболевания.
Интермиттирующая гормональная терапия
ИГТ используется для задержки образования гормонорезистентных клеток РП, уменьшения риска появления негативных побочных явлений и понижения общей стоимости лечения. Гормональная терапия сопровождается до того времени, пока значение ПСА не опустится до исходного уровня. Затем прием препарата прекращается, а за больным выполняется постоянное наблюдение. Как только обнаружится повторное ухудшение состояния – прием препаратов возобновляется.
Используемые методы определения начала назначения агонистов ЛГРГ с учетом уровня тестостерона признаны безопасными, эффективными, дают возможность значительно уменьшить стоимость дальнейшего лечения.
Агонисты ЛГРГ в терапии распространенного рака

Таблица 2. Оптимальная последовательность различных методов гормонотерапии
В зависимости от индивидуальных особенностей организма больного гормонотерапия при раке предстательной железы может вызывать те или иные побочные действия. Приливы наблюдаются у 50–70% пациентов, гинекомастия до 15%, тошнота и рвота у 0,13%, на импотенцию и снижение либидо жалуются до 100% больных. Серьезной проблемой для пациентов, длительное время принимающих препараты, является прогрессирующий остеопороз. Врачи должны внимательно наблюдать за ними и рекомендовать соответствующие поведение и лечебные препараты. Но во всех случаях эти симптомы нельзя считать критичными, по их показанием отменяется лечение лишь у 0–4% пациентов.
В зависимости от стадии развития болезни используется три протоколы гормонального лечения.
- Локализованная стадия. Для уменьшения объема железы, улучшения состояния здоровья больного перед хирургическим вмешательством и сужения поля облучения тканей при лучевой терапии назначается неоадъювантная гормонотерапия агонисты-ГнРГ ± антиандрогены. Такие же препараты рекомендовано принимать и при острой необходимости по клиническим показаниям отсрочить основное лечение. Продолжительность приема гормональных препаратов лечащий врач назначает индивидуально каждому пациенту на основании последних лабораторных анализов и с учетом его самочувствия.
- Распространенная стадия. Рекомендуется адъювантная гормонотерапия агонисты-ГнРГ ± антиандрогены одновременно с курсом лучевой терапии. Если уровень ПСА Вывод: Профилактика болезней во время гормонотерапии необходима
В результате приема гормональных препаратов повышаются риски заболевания диабетом и возникновения проблем с сердечно-сосудистой системой. Больному запрещается курение и употребление всех алкогольных напитков, рекомендуют препараты кальция и железа. Рекомендуется снизить вес до физиологической нормы, придерживаться сбалансированного здорового питания. Очень важную роль играют положительные эмоции, нацеленность на борьбу с болезнью. Если пациент не может самостоятельно управлять своим психическим состоянием, то надо обращаться врачам-психотерапевтам.
При этом речь, естественно, идет о паллиативной терапии, поскольку в течение приблизительно двух лет погибает более чем половина пациентов вследствие прогрессии опухоли, поскольку она становится полностью нечувствительной к проводимой дальнейшей гормональной терапии.
Опухолевый рост можно только временно контролировать; спустя определенный промежуток времени прогрессия рака становится неизбежной.
Интермиттирующая андрогенная блокада
Базирующаяся на экспериментальных и доклинических исследованиях интермиттирующая андрогенная блокада представляется потенциальной альтернативой постоянной, т.е. непрерывной блокаде. Принцип подобной прерывистой тактики лечения антиандрогенами учитывает явное снижение токсичности, а патогенетический механизм предполагает рост нового клона андрогенчувствительных клеток, в основном стволовых, оставшихся от предшествующего курсового лечения.
Увеличение количества таких клеток замедлено, чему способствует удлинение периода ремиссии. Лечение антиандрогенами должно возобновляться, как только клон злокачественных клеток достигает определенного уровня. Чаще всего время начала нового курса лечения устанавливается после оценки уровней сывороточного простатспецифического антигена (ПСА), несколько реже избирается интуитивно, но с учетом клинических проявлений.
Вследствие цикличности обратимого андрогенного подавления происходят восстановление апоптоза и последующее замедленное развитие опухоли вплоть до очередного андрогеннезависимого состояния.
Высказывается мнение, что благодаря интермитирующему проведению андрогенной аблации сохраняется длительный апоптотический потенциал и замедляется развитие гормональной резистентности (N. Bruchovsky et al., 1996).
С пониманием роли апоптоза (программированной клеточной смерти) было отмечено, что прогрессирование связано с активированием прежде всего андрогенподавляющих генов, некоторые из них могут нести код аутокринных или паракринных факторов роста, замещающих андрогены в поддержании жизнеспособности опухолевогенных стволовых клеток (К. Akakura et al., 1993).
Замена андрогена до начала прогрессирования должна вызвать увеличение андрогензависимой опухоли, поддающейся повторному воздействию с отменой андрогенов. В экспериментальных моделях этот подход привел к трехкратному удлинению продолжительности андрогенной зависимости (рис. 103).

Рис. 103. Концепция интермиттирующей антиандрогенной терапии

Схема 8. Механизм интермиттирующей андрогенной депривации
Дополнительный аргумент в пользу проведения интермиттирующей андрогенной депривации появился на основе многочисленных наблюдений выраженных расстройств полового влечения и потери потенции при длительном непрерывном применении гормональной терапии. Синдром недостаточности поступления андрогенов в значительной степени повысил частоту остеопороза, анемии и привел в ряде случаев к клинически выраженным явлениям мышечной атрофии.
В связи с этим в последнее время увеличилось количество исследований об использовании менее агрессивных эндокринологических стратегий в терапии рака простаты. При этом считается одной из наиболее рациональных интермиттирующая андрогенная депривация. При интермиттирующей андрогенной депривациичередуются фазы эндокринной терапии с интервалами, свободными от этого вида лечения.
Предполагаем, что при проведении интермиттирующей терапии контроль над раковым процессом может быть обеспечен путем преодоления развития резистентности к влиянию гормональной депривации.
Теоретическое обоснование может происходить:
а) путем блокирования появившихся спонтанных мутаций андрогенных рецепторов, связанных со средой, лишенной гормонов;
б) путем создания препятствия повышенному выделению андрогенных рецепторов — явления, как предполагается, происходящего в среде, лишенной андрогенов.
ИАД проводится с целью не только минимизации побочных профилей воздействия андрогенной депривации, ее эффективность состоит также и в том, чтобы временным интервалом удлинить облигатную андрогенную зависимость.
Известно, что андрогенная зависимость четко проявляется в начале программированной клеточной смерти (апоптоза) при условии недостаточности андрогенов. Вместе с этим андрогенная депривация ведет не только к апоптозу, но и к задержке синтеза ДНК.
Качество жизни пациентов
Далее клинически отмечается, что качество жизни пациентов вследствие смены фаз с и без лечения значительно улучшается. Одновременно остается не до конца ясным, насколько позитивным является влияние подобной тактики на сроки выживания. Клинические исследования должны пролить свет на эту проблему, чтобы оценить влияние данного вида терапии на сроки и продолжительность качества жизни. Поэтому в рамках клинического исследования ИАД является одновременно и моделью экспериментальной терапии.
Несмотря на высокий первоначальный ответ на проводимое лечение, достигающий 80% при любого вида антиандрогенной терапии, приблизительно у 50% пациентов с метастазирующим раком простаты в течение двух лет возникает прогрессия опухолевого роста.
Средний срок выживания, свободного от прогрессии, составляет у этих пациентов от 12 до 33 месяцев, а средняя продолжительность жизни — от 23 до 37 месяцев. Даже максимизация андроген-супрессивной терапии путем дополнительной блокады надпочечниковых андрогенов увеличивает время до появления прогрессии только на 3-6 месяцев (L. Denis, G. Р. Murphy, 1993).
Причина состоит в том, что вследствие поступления андрогенов индуцированным процессом клеточной смерти вся злокачественная популяция не охватывается, напротив, способность к прогрессии рака простаты возрастает и ведет к андрогеннезависимо-му состоянию.
В нормальных условиях существует три варианта андрогеносопровождающей регуляции в нормальной ткани простаты:
1) позитивный эффект на инициацию синтеза ДНК и клеточную пролиферацию;
2) негативный или тормозящий эффект, лимитирующий число клеток в предстательной железе;
3) апоптоз, форма контролируемой клеточной смерти, когда при недостатке андрогенов активно элиминируются (выводятся) простатические клетки.
Следствием гормональной достаточности достигается клиническая корреляция апоптоза как в нормальной, так и в злокачественной ткани (N. Bruchovki et al., 1996). Доставка андрогенов активизирует на хромосомальиой поверхности клеточную программу, ведет к конденсации клеточного ядра, фрагментации митохондрий с последующим крушением энергетического обеспечения клетки.
Присоединяющиеся расстройства проницаемости клеточной мембраны заканчиваются дезорганизацией внутриклеточной среды. Непосредственно после этого остатки клочок уничтожаются в процессе фагоцитоза. Вместе с тем, апоптоз является клеточно-биологическим основополагающим феноменом и сопровождается поражением отдельных клеток. Последствием его становится некроз с разрушением большого количества клеточных связей, вследствие чего образуются рубцы.
Возможно, углубление наших знаний об апоптозе поможет продлить выживание пациентов без страданий, но любая надежда полного излечения является проблематичной.
На ранней стадии рака простаты отсутствует форма андрогенсвязанной регуляции, и, соответственно, ограничено количество опухолевых клеток. Поскольку другие два механизма все еще функционируют, удаление андрогенов имеет двойной эффект приведения в действие апоптоза. Способность подвергаться апоптозу — отличительная черта влияния андрогенов, при отсутствии которых делящиеся клетки вновь становятся доапоптическими.
Подразумевается, что длительные периоды без лишения гормонов ускоряют развитие автономного роста. N.L. Sanford et al. (1983) убедительно продемонстрировали и в эксперименте последовательные волны апоптоза в предстательной железе у крыс. Кастрация самца крысы вызывает атрофию вентральной предстательной железы. Возмещение тестостерона приводит к восстановлению гистологически нормальной предстательной железы за 10 дней.
Когда крыс лечили циклами лишения и восполнения тестостерона, каждое последовательное его удаление вызывало массовое отмирание клеток. Через три дня после кастрации наблюдалось 35-кратное увеличение апоптических тел, что подтверждало важную роль апоптоза в сокращении эндокринно-зависимых тканей.
Широко известен тот факт, что нормальные эпителиальные клетки предстательной железы подвергаются выраженному апоптозу и не обладают способностью регенерировать в андрогенистощенной среде.
Примечателен и другой факт: развитие андрогенной независимости почти всегда происходит после лечения прекращением выработки андрогенов у пациентов с раком предстательной железы (J.M. Wolff, U.W. Tunn, 2000). Отсутствие эффекта от андрогенной депривации можно объяснить наличием ранее существующих клонов андрогеннезависимых клеток, в которых апонтический процесс не начинается (клональная селекция). Существует и субпопуляция клеток, апонтический потенциал которых подавлен путем регуляции их адаптивных механизмов (N. Bruchovsky et al., 1990).
Клинический интерес представляет ряд экспериментальных исследований, свидетельствующих о том, что эффективность лишения андрогенов возможна только при лечении андрогензависимого рака (J.Trachtenberg, 1987). Уровень сывороточного ПСА используется как суррогатный показатель повторной активизации заболевания в промежутках без лечения в основном с пороговыми значениями 10 нг/мл, что является сигналом для возобновления лечения.
Накопленный клинический опыт использования интермиттирующей тактики с лечебными циклами продолжительностью приблизительно восемь месяцев и переменными перерывами ориентировочно в три месяца допускает оправданность такого вида лечения.
Отмечается, что у больных с локальным рецидивом, возникшим после лучевой терапии или радикальной простатэктомии, прерывается антиандрогенная терапия, включающая аналоги лютеинизирующего рилизинг-гормона (ЛГРГ) в сочетании с антиандрогенами и сопровождающаяся более продолжительным сроком выживания, имеет тенденцию к не менее длительным интервалам без лечения и замедленному развитию гормональной резистентности. Следовательно, эти пациенты могут стать более подходящим контингентом для такого вида терапии.
Эффективность и длительность интермиттирующей гормонотерапии
D. Prapotnich et al. (2003) уточняли эффективность и длительность интермиттирующей гормонотерапии у 233 пациентов, леченных с помощью различных методик (радикальная простатэктомия, высокоинтенсивный сфокусированный ультразвук). Трехмесячная инъекция аналогов ЛГРГ комбинировалась с нестероидными антиандрогенами.
Лечение прекращалось, когда уровень простатспецифического антигена понижался до 4 нг/мл. Критерием для возвращения к гормонотерапии был ПСА выше 20 нг/мл, прогрессия его за 3 месяца более 5 нг/мл в течение месяца, рецидив болей или мочевых симптомов. Среднее время выживания составило 42,2 месяца. Авторы делают заключение о возможном обеспечении контроля за опухолью в течение трех лет и отсутствием выраженных осложнений.
Интермиттирующая терапия не показана:
• пациентам с первичными опухолями больших размеров;
• уровнем простатспецифического антигена более 100 нг/мл;
• пациентам с выраженными болями;
• пациентам с быстро возрастающим уровнем ПСА (> 5 нг/мл в месяц).
Андрогеннезависимость означает для клеточной поверхности потерю апоптотического потенциала. В злокачественных клетках апоптоз может состояться только после их дифференциации под влиянием андрогенов, поскольку недифференцированные и преапоптически делящиеся клетки могут быть в андрогеносвободной среде. Этот феномен объясняет, почему новый рост опухолевых клеток протекает андроген независимо.
В поисках средств замедления прогрессии была выдвинута гипотеза, согласно которой злокачественные клетки, выжившие в условиях андрогенной субституции, благодаря андрогенному насыщению, можно ввести в нормальный цикл клеточной дифференциации. Непосредственно после этого снова возможен апоптоз, и вероятность новой андрогенной недостаточности опять индуцирует ремиссию (К. Akakura et al., 1993; N. Bruchovsky et al., 1996).
Вместе с тем, несколько вопросов остаются без ответа, и касаются они лечения интермиттиру-ющей андрогенной блокадой и сроков выживания. Остаются не ясными критерии отбора наиболее подходящих для такого вида лечения пациентов. Трудно измерить и такой показатель, как качество жизни, особенно в период восстановления уровня тестостерона, когда никакое лечение не проводится.
Проблематично и раннее распознавание развития новой активизации заболевания, устанавливаемой только на основании определения уровня ПСА. Вероятно, более надежными являются биохимические показатели, такие, как определение циркулирующих клеток рака простаты в периферической крови, использование обратимой цепной полимеразной реакции транскриптазы и др.
Несмотря на множество нерешенных проблем, использование терапевтического варианта интермиттирующей андрогенной блокады вполне оправдано и является еще одним шансом в продлении жизни больных распространенным раком простаты. Целесообразность подтверждается полным отсутствием каких-либо осложнений или неблагоприятных реакций.
Помимо отмеченных преимуществ, интермиттирующая терапия позволяет восстановить потенцию, поскольку начинают функционировать яички, сокращается стоимость лечения и менее выражена кумулятивная токсичность применяемых лекарств. Кроме этого, поддерживание андрогензависимого состояния опухоли открывает возможность использования других вариантов лечения (N. Bruchovsky et al., 1997).
В идеале терапия выключением андрогенов должна продолжаться в течение периода, когда необходимо максимально увеличить апоптоз опухоли, и затем остановиться, как только начнут появляться андрогеннезависимые клетки. Если терапия отменяется чересчур рано, клетки, запрограммированные на апоптоз, выживут, поскольку уровни тестостерона возрастут снова.
После отмены происходит немедленное падение уровней простатспецифического антигена, тогда как андрогенрегулируемая ПСА-генная экспрессия прекращается, вслед за чем следует плавное снижение, поскольку объем опухоли изменяется из-за апоптоза (N. Bruchovsky et al., 1997). Установить время начала реинтродукции терапии довольно сложно, поскольку определяется индивидуальным подходом с тщательным взвешиванием и учетом различных клинических факторов.
Согласно нашим клиническим наблюдениям, лечение поддерживается в течение значительного периода — 6-9 месяцев до получения устойчиво низкого уровня ПСА (4 нг/мл) и возобновляется, когда показатели достигают величины 20 нг/мл.
При назначении интермиттирующей андрогенной депривации надо ориентироваться на показатели уровней ПСА до лечения, скорость нарастания ПСА, стадию опухоли и выраженность симптомов.
Рак простаты (предстательной железы, ПЖ) является гормонально зависимой опухолью. Это значит, что ее рост провоцирует воздействие половых гормонов, в частности тестостерона. В клетках железы он превращается в другой, более активный андроген — дигидротестостерон (ДГТ), который при возникновении злокачественной трансформации стимулирует активацию онкогенов и, как следствие, бесконтрольное деление и размножение опухолевых клеток. Если это воздействие прекратить, то рост опухоли остановится. Гормональная терапия не является методом радикального удаления рака, но она может сдерживать его прогрессирование или ремиссию довольно долгое время.
- Молекулярная основа гормонального лечения рака ПЖ
- Принцип действия андрогенной блокады
- Двусторонняя орхэктомия (кастрация)
- Применение эстрогенов
- Агонисты ЛГРГ
- Антагонисты ЛГРГ (дегареликс)
- Антиандрогенное лечение (антагонисты андрогенных рецепторов)
- Комбинированное гормональное лечение
- Интермиттирующее гормональное лечение
- Немедленное или отложенное гормональное лечение рака простаты
- Наблюдение пациентов, проходящих гормональное лечение
- Осложнения гормонального лечения рака ПЖ
Гормональное лечение оказывает эффект более чем у 90% больных раком предстательной железы (ПЖ), даже в случае диссеминированных форм. Поэтому его можно применять в том числе с паллиативной целью. Но и при курабельных (потенциально излечимых) опухолях, этот метод имеет большое значение в рамках комбинированного воздействия совместно с радикальной операцией или лучевой терапией. Используются режимы адъювантной и неоадъювантной терапии, в качестве дополнения к хирургической операции или облучению. Кроме того, исследуются альтернативные схемы и режимы, например, интермиттирующая терапия.
Молекулярная основа гормонального лечения рака ПЖ
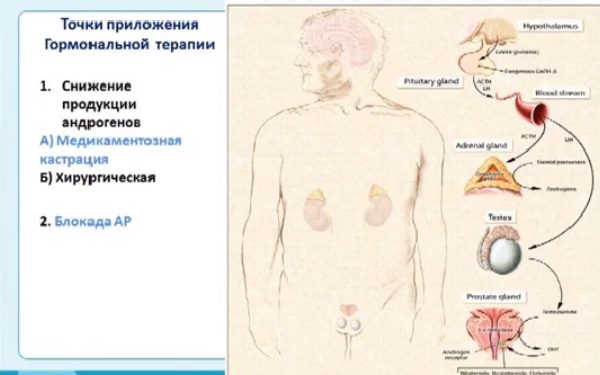
Чтобы понять, как работает гормональная терапия, давайте разберемся, как функционирует мужская половая система.
Мужские половые гормоны называют андрогенами. Основным из них является тестостерон. Он вырабатывается яичками (тестикулами). На его долю приходится около 95% всех андрогенов в организме мужчины. Продукцию тестостерона регулирует гипоталамо-гипофизарная система. Гипоталамус вырабатывает рилизинг гормон лютеинизирующего гормона (ЛГРГ), который действует на гипофиз, который, в свою очередь, продуцирует лютеинизирующий гормон (ЛГ). Именно ЛГ действует на особые клетки в яичках, которые вырабатывают тестостерон.
Оставшиеся 5% андрогенов вырабатывают надпочечники. При этом здесь синтезируется как прямой тестостерон, так и его предшественники — андростендион и дегидроэпиандростерон. Они превращаются в тестостерон уже в тканях простаты.
После попадания в клетки ПЖ, тестостерон превращается в дигидротестостерон (ДГТ) — вещество, по активности превосходящее своего предшественника в 2,5 раза. Именно он и отвечает за регуляцию внутриклеточных процессов путем присоединения к рецепторам ядра и стимулируя экспрессию генов. В том числе стимулируются и онкогены, которые приводят к неконтролируемому росту и размножению злокачественных клеток.
Таким образом, яички и надпочечники — это два источника андрогенов в организме мужчин. Раньше гормональная терапия предполагала только подавление выработки тестостерона яичками. Однако в настоящее время имеются данные о том, что андрогены также могут спровоцировать рост опухоли. Поэтому сейчас рекомендовано проводить блокаду по двум направлениям.
Принцип действия андрогенной блокады
Антиандрогенная блокада направлена на предотвращение стимуляции раковых клеток мужскими половыми гормонами. С этой целью могут проводиться следующие мероприятия:
- Хирургическое удаление яичек, которые, как было сказано выше, вырабатывают около 95% всех андрогенов.
- Блокада синтеза андрогенов с помощью медикаментозных препаратов. Блоки могут осуществляться на разных уровнях гипоталамо-гипофизарно-андрогенной системы.
- Блокада циркулирующих андрогенов. В этом случае клетки ПЖ становятся невосприимчивыми к действию половых гормонов, но общий уровень тестостерона в крови остается в нормальных пределах.
Таким образом, применяются следующие виды гормонального лечения:
- Хирургическое удаление яичек — двусторонняя орхэктомия.
- Применение агонистов лютеинизирующего гормона рилизинг-гормона (ЛГРГ).
- Терапия антагонистами ЛГРГ.
- Эстрогенотерапия.
- Антиандрогенная терапия.
Стабилизация онкологического процесса и, как следствие, качество жизни пациентов напрямую зависит от того, как долго рак будет реагировать на антигормональную терапию. Дело в том, что злокачественное новообразование — это скопление относительно разнородных клеток. При раке ПЖ большинство из них изначально имеют зависимость от гормональной стимуляции. При постоянной терапии часть из них погибает или останавливается в росте и размножении. Однако всегда есть минимум 20% гормонально независимых клеток. Со временем их клон становится преобладающим, и заболевание выходит из-под гормонального контроля — развивается гормональная резистентность.
Диагноз гормонально резистентный рак простаты устанавливается при прогрессировании заболевания на фоне адекватной андрогенной блокады, подтвержденной лабораторно. Иными словами, опухоль прогрессирует на фоне кастрационного уровня тестостерона (не выше 2 нмоль/л). В настоящее время одним из направлений лечения онкологии простаты является время продления гормональной чувствительности. С этой целью разрабатываются различные схемы лечения:
- Интермиттирующая андрогенная блокада (ИАБ).
- Минимальная андрогенная блокада.
- Отложенная гормональная терапия.
Двусторонняя орхэктомия (кастрация)
Двусторонняя орхэктомия, или хирургическая кастрация, был самым первым методом гормональной блокады при раке ПЖ. Снижение уровня тестостерона в этом случае достигается уже в течение 12 часов. Психологически эта операция очень тяжело переносится пациентами, поскольку оказывает необратимый эффект. Более того, необратимость эффекта неблагоприятно сказывается и при прогрессировании заболевания, поскольку ограничивает резервы воздействия.
Но в последнее время оно опять набирает популярность ввиду некоторых обстоятельств:
- Аналоги ЛГРГ характеризуются довольно высокими кардиотоксическими рисками. Внешние и эстетические изменения при их приеме аналогичны кастрации.
- Хирургическое удаление оказывает быстрый терапевтический эффект.
- Стоимость такого лечения гораздо ниже пожизненного приема лекарственных препаратов.
Применение эстрогенов
Эстрогены блокируют выработку ЛГ и ФСГ и, соответственно, это приводит к подавлению синтеза тестостерона. Как результат, наступает клиническая и биохимическая ремиссия рака простаты. Эстрогены могут применяться в рамках терапии первой и второй линии. Их недостатком являются следующие аспекты:
- Необходимость ежедневного введения с помощью внутримышечных инъекций.
- Высокие кардиотоксические риски, приводящие к повреждению миокарда и сосудов. Особенно высоки риски при применении высоких доз препаратов.
Агонисты ЛГРГ
Аналоги ЛГРГ (гозерелин, лейпрорелин и др). Эти препараты подавляют выделение гипофизом ЛГ за счет десенсибилизации его рецепторов, что приводит к снижению уровня тестостерона. При отмене препаратов, продукция гормонов нормализуется и приходит в норму.
Особенностью данного лечения является увеличение выброса тестостерона на начальных этапах терапии. Это явление получило название эффект вспышки. Происходит это за счет того, что при первом приеме препарат вызывает выброс большого количества ЛГ в кровь, что приводит к выработке большого количества тестостерона, превосходящего нормальные значения. Это явление называется эффект вспышки.
Агонисты ЛГРГ широко используются для терапии рака простаты ввиду ряда преимуществ. Основные из них это обратимость эффекта и довольно благоприятный профиль осложнений.
Антагонисты ЛГРГ (дегареликс)
Дегареликс вводят с помощью инъекции, обязательно в присутствии врача. В первый месяц его применяют раз в 2 недели, а потом раз в 4 недели. После каждой инъекции пациент еще около получаса остается под наблюдением медперсонала, чтобы удостовериться в отсутствии аллергической реакции.
Антиандрогенное лечение (антагонисты андрогенных рецепторов)
Антиандрогенные препараты препятствуют взаимодействию андрогена с андрогенным рецептором и тем самым подавляют его активацию. Применяется два типа таких препаратов — стероидные и нестероидные. Их эффективность в борьбе с раком простаты идентична, но есть различия в плане побочных реакций. Например, нестероидные препараты действуют только на уровне предстательной железы, а стероиды оказывают эффект и на гипофиз, приводя к развитию гинекомастии, потере потенции и либидо.
Комбинированное гормональное лечение
Комбинированное гормональное лечение предполагает одновременное применение препаратов с разным механизмом действия. К ним относят минимальную и максимальную андрогенную блокаду.
Химическая или хирургическая кастрация приводит только к устранению тестостерона, вырабатываемого яичками. Однако остаются еще гормоны, продуцируемые надпочечниками. Их удельный вес от общего количества хоть и небольшой, но они все равно могут стимулировать рост и развитие раковых клеток ПЖ.
Чтобы это предотвратить, применяют дополнительные препараты, которые блокируют синтез гормонов надпочечников. Таким образом достигается полная блокада всех циркулирующих в крови андрогенов. Такая терапия получила название максимальная андрогенная блокада (МАБ). Раньше считалось, что она повышает общую выживаемость пациентов. Но при проведении больших клинических испытаний было установлено, что существенного продления жизни для пациентов с метастазами достигнуть не удалось. Вместе с тем, хирургическая кастрация, как самостоятельный метод лечения, обеспечивал немного лучшее качество жизни таких больных, по сравнению с медикаментозной терапией.
Таким образом, можно сделать следующие выводы относительно МАБ:
- Применение максимальной андрогенной блокады дает лучшие результаты лечения по сравнению с кастрацией не более, чем у 10% больных, проходящих первичную терапию.
- Не дает существенных различий в рамках двухлетней общей выживаемости.
- Оказывает гораздо больше побочных эффектов.
- Намного дороже других видов лечения.
В основном ее применяют в тех случаях, когда уже исчерпаны возможности химической или хирургической кастрации.
Минимальная андрогенная блокада предполагает применение антиандрогена и ингибитора 5-альфа-редуктазы (финастренид). Данный препарат блокирует действие 5-альфа редуктазы — фермента, который превращает тестостерон в его активную форму — дигидротестостерон. А нестероидные антиандрогены предотвращают взаимодействие остаточного ДГТ с рецепторами злокачественных клеток. Половая функция при этом сохраняется у 60-88% больных.
На какое-то время это лечение сдерживает опухолевый рост и отсрочивает необходимость применения кастрации. В среднем этот срок составляет около 37 месяцев. И только тогда, когда лечение перестает действовать, прибегают к более радикальным шагам. В настоящее время такое лечение проходит клинические испытания и изучается его возможность в отсрочке наступления вторичной гормонорезистентности рака простаты.
Интермиттирующее гормональное лечение
Интермиттирующее гормональное лечение представляет собой целенаправленное чередование периодов блокады и восстановления гормональной стимуляции рака. Это позволяет частично сохранять гормонально зависимый клон злокачественных клеток, тем самым отсрочив развитие гормональной резистентности.
Лечение проводят по следующей схеме:
- В первую очередь, назначается гормональная терапия. Происходит это до тех пор, пока уровень ПСА не станет ниже 4 нг/мл.
- Затем терапию отменяют и продолжают наблюдать за уровнем ПСА.
- Когда ПСА превысит установленное значение, например, 20 нг/мл, терапию возобновляют, и так по кругу.
Такая схема позволяет продлить период ремиссии и дает меньше побочных реакций, чем постоянная блокада. И что важно для системы здравоохранения в общем — это дешевле перманентного курса препаратов.
Немедленное или отложенное гормональное лечение рака простаты
В конце ХХ века было предположено, что гормональную терапию рака ПЖ можно отложить до тех пор, пока опухоль не начнет прогрессировать, т. е. пока не начнется рост первичного очага, или не возникнут отдаленные метастазы. Считалось, что в этом случае останется еще один шанс на выход в ремиссию.
Однако клинические испытания показали неоднозначный результат. Например, в группе отсроченного гормонального лечения чаще и раньше начиналось прогрессирование рака и чаще возникали отдаленные метастазы. Общая смертность за период наблюдения также была выше в группе отсроченной терапии. Таким образом, большинство исследователей на сегодняшний день склоняются к необходимости немедленного начала гормонального лечения.
Наблюдение пациентов, проходящих гормональное лечение
Эффект от гормонального лечения рака ПЖ оценивается через 3 и через 6 месяцев после его начала. Обследование включает измерение уровня ПСА и пальцевое ректальное исследование. При отсутствии метастазов, дальнейшее наблюдение рекомендуют выполнять раз в 6 месяцев. Если метастазы есть, но лечение оказало положительный эффект, наблюдение проводят раз в 3 месяца. Если злокачественный процесс стабилизирован, дополнительных методов медицинской визуализации не требуется (УЗИ, КТ, сцинтиграфия и др).
Осложнения гормонального лечения рака ПЖ
Отсутствие половых гормонов приводит к развитию половой дисфункции и симптомов, характерных для климакса. Существуют общие побочные эффекты, характерные для гормональной терапии в целом, и индивидуальные, которые развиваются при назначении определенных препаратов.
К общим эффектам относят:
- Эректильную дисфункцию.
- Снижение либидо.
- Гинекомастию — увеличение размеров грудных желез.
- Остеопороз — уменьшение плотности и массы костной ткани, что сопровождается их повышенной хрупкостью и увеличением риска переломов.
- Саркопения — убыль мышечной массы.
- Нервно-психические расстройства.
- Приливы — периодические чувства жара при нормальной температуре тела и окружающей среды.
При приеме эстрогенов и антиандрогенов могут развиться следующие побочные эффекты:
- Патология сердца.
- Нарушение функции печени.
- Гастроинтестинальные расстройства — боль в животе, диарея, тошнота или рвота.
Наиболее высокие риски развития осложнений характерны для эстрогенов. Помимо вышеперечисленных побочных эффектов, они могут вызывать выраженные отеки и образование тромбов. Последнее в ряде случаев может привести к угрозе жизни. Поэтому эстрогены в настоящее время используются в рамках терапии второй и последующих линий, когда другие методы лечения не перестали оказывать должный эффект.
Читайте также:


