Актуальность проблемы рака легкого
(495) -506 61 01
Лечение рака в Германии ¦ Рак легких - диагностика рака легкого в Германии
Ежегодно в мире регистрируют около 1 миллиона новых случаев злокачественной онкологии. Из них рак легкого составляет 12%. Этот вид новообразований занимает первое место в структуре мужской онкологии стран Европы и постсоветского пространства. У женщин рак легких диагностируют в 3-10 раз реже. В большинстве индустриально развитых стран рак легкого лидирует в структуре онкологической смертности. Это обусловлено хорошим кровоснабжением ткани легкого и, следовательно, быстрым гематогенным распространением заболевания.
Ни одно из известных онкологических заболеваний не имеет такой очевидной связи с вредными привычками, факторами окружающей среды и условиями труда, как рак легкого. Его связь с курением достигает 85-90%. Курильщики заболевают в 30 раз чаще, чем некурящие. Вторым по значимости этиологическим фактором являются вредные условия на производстве: асбест, соединения мышьяка, никеля, хрома и др. Кроме того, существуют данные, указывающие на связь между хроническими заболеваниями легких (пневмосклероз, хронические обструктивные болезни легких - ХОБЛ) и возникновением рака легкого.
Проблема скрининга рака легкого является одной из самых обсуждаемых в современной онкологии. Принятое в странах СНГ ежегодное флюорографическое обследование редко позволяет выявить рак легкого на ранних стадиях, когда лечение может быть эффективным. Флюорография отличается дешевизной, но снимок легких получается небольших размеров. На нем рассмотреть ранние формы рака не представляется возможным. Выявление заболевания на поздних стадиях, как правило, имеет неблагоприятный прогноз. БОльшими диагностическими возможностями и меньшей лучевой нагрузкой обладает рентгенография органов грудной клетки, но поскольку рентгенологическая пленка содержит серебро, это относительно дорогой метод обследования, который государство не может оплатить в качестве бесплатного массового скрининга.
В Германии обсуждается возможность скрининга низкодозной компьютерной томографией (КТ) и исследованием мокроты на наличие атипичных клеток у пациентов, находящихся в группе риска. На государственном уровне из-за экономического кризиса в качестве ежегодного скрининга проект поддержки пока не получил, однако все ведущие торакальные онкоцентры его рекомендуют.
Факторы риска рака легких:
- Наследственно обусловленные. (Онкология у 3-х близких родственников или рак в анамнезе).
- Внешние. (Табакокурение, летучие канцерогены).
- Эндогенные. (ХОБЛ, возраст после 50-ти лет, пневмофиброзы, туберкулез, эндокринопатии и др.).
При выявлении очаговых и\или прикорневых изменений во время скрининга стандартами качества диагностики рака легкого в Германии приняты:
- Многослойная КТ.
- Магнитно-резонансная томография с контрастированием (кМРТ).
- Позитронно-эмисионная томография (ПЭТ), которая позволяет визуализировать жизнеспособную опухолевую ткань и оценить её активность по степени интенсивности накопления меченой глюкозы.
- Бронхоскопия с получением материала для дальнейшего гистологического исследования (биопсия).
- Цитологическое и гистологическое изучение биоптата, мокроты и\или плевральной жидкости.
- Сцинтиграфия и УЗИ брюшной полости при подозрении на метастазирование.
- Молекулярно-генетические методы. Например, для назначения таргетной терапии, определения тактики лечения и прогноза заболевания используются полимеразная цепная реакция (ПЦР), секвенирование и др.
- Онкомаркеры (NSE – мелкоклеточный рак, SSC, CYFRA – плоскоклеточный рак и аденокарцинома, РЭА – универсальный маркер) определяют у пролеченных пациентов для выявления раннего метастазирования и рецидивов.
(495) 506-61-01 - срочная диагностика и лечение рака в Германии

В Германии, несмотря на двукратное увеличение заболеваемости раком молочной железы с 1970 г, уровень смертности остается стабильным – около 17 тыс. ежегодно. Независимо от стадии карциномы средняя 5-ти летняя выживаемость составляет 86%. Статистика улучшается ежегодно.Подробнее
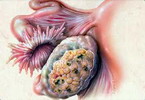
В Германии все женщины в постменопаузе ежегодно проходят трехмерное УЗИ, включая исследование интравагинальным датчиком. При получении сомнительных данных на УЗИ определяют онкомаркер СА-125 и проводят генотипирование по генам BRCA – 1 и 2. Подробнее
Опухоли у детей, в отличие от взрослых, растут быстрее и уже в течение нескольких недель после заболевания могут проявляться, но лечить их легче, поэтому своевременная диагностика заболевания поможет быстрее избавиться от опухоли и поспособствует полноценному выздоровлению. Подробнее
Другие разделы по онкологии
-
- Рак мозга
- Рак груди
- Рак яичников
- Рак шейки матки
- Рак простаты
- Рак желудка
- Рак печени
- Рак легких
- Рак костей
- Меланома
- Рак почек
- Рак мочевого пузыря
- Рак щитовидной железы
- Рак надпочечников
- Опухоли головы и шеи
- Рак горла
- Рак толстой и прямой кишки
- Рак поджелудочной железы
- Онкогематология - рак крови
- Кибер-нож
- Протонная терапия опухолей
- Химиотерапия в лечении рака в Германии
- Брахитерапия в лечении рака в Германии
- SIRT терапия в лечении рака в Германии
- Кибер-Нож в лечении рака в Германии
- Рак у ребенка - диагностика рака у детей в Германии
- Лечение рака у детей в Германии
- Клиники по лечению рака у детей в Германии
- Специалисты по лечению рака у детей в Германии
- Диагностика и лечение лимфомы Ходжкина в Германии
- Диагностика и лечение опухолей мозга в Германии
- Рак простаты - диагностика рака простаты в Германии
- Лечение рака простаты в Германии
- Ведущие клиники и специалисты по лечению рака простаты в Германии
- Рак молочной железы - диагностика рака молочной железы в Германии
- Лечение рака молочной железы в Германии
- Клиники и центры лечения рака молочной железы в Германии
- Рак яичников - диагностика рака яичников в Германии
- Лечение рака яичников в Германии
- Клиники лечения рака яичников в Германии
- Рак легких - диагностика рака легкого в Германии
- Лечение рака легких в Германии
- Клиники лечения рака легкого в Германии
- Рак пищевода - диагностика рака пищевода в Германии
- Лечение рака пищевода в Германии
- Клиники и центры по лечению рака пищевода в Германии
- Рак желудка - диагностика и лечение рака желудка в Германии
- Клиники и центры по лечению рака желудка в Германии
- Рак поджелудочной железы - диагностика рака поджелудочной железы в Германии
- Лечение рака поджелудочной железы в Германии
- Клиники и центры по лечению рака поджелудочной железы в Германии
- Рак печени - диагностика и лечение рака печени в Германии
- Немецкие онкологические клиники и центры, специализирующиеся на диагностике и лечении рака печени
- Диагностика и лечение рака прямой и толстой кишки в Германии
- Клиники и центры по лечению рака прямой и толстой кишки в Германии
- Диагностика и лечение рака почки в Германии
- Клиники по лечению рака почки в Германии
- Диагностика и лечение рака мочевого пузыря в Германии
- Клиники для диагностики и лечения рака мочевого пузыря в Германии
- Диагностика и лечение рака ЛОР органов в Германии
- Клиники для лечения рака ЛОР-органов в Германии
- Диагностика и лечение рака щитовидной железы в Германии
- Клиники и центры по лечению рака щитовидной железы в Германии
- Рак кости - диагностика остеогенной саркомы в Германии
- Лечение рака кости в Германии
- Рак кожи - диагностика рака кожи в Германии
- Лечение рака кожи в Германии
- Диагностика и лечение меланомы в Германии
- Диагностика рака простаты в Берлине
- Лечение рака - второе мнение в Берлине
- Лечение лимфомы в Берлине
- Острая лейкемия: когда можно начинать лечение в Германии?
- Брахитерапия при раке простаты в Берлине
Данный интернет-сайт носит исключительно информационный характер и ни при каких условиях не является публичной офертой, определяемой положениями Статьи 437 (2) Гражданского кодекса Российской Федерации
Рак легкого остается одной из важнейших медицинских и социально-экономических проблем в нашей стране и большинстве развитых стран мира. В России рак легкого в 2003 году выявлен у 58,8 тыс. человек и являлся ведущей локализацией в общей структуре заболеваемости злокачественными новообразованиями (12,5%), а среди мужского населения занимал первое место – 22,8% (Чиссов В.И., Старинский В.В., Петрова Г.В., 2005).
В настоящее время хирургическое лечение является основным методом, дающим надежду на продление и улучшение качества жизни больных раком легкого – оно проведено в 2000 году у 38,1% больных, получавших противоопухолевое лечение (Аксель Е.М., 2003; Напалков Н.П., 2004).
Достигнутые успехи в торакальной хирургии разрешили техническую сторону оперативного лечения данной патологии. Более чем 70-летний опыт его использования позволяет успешно решать вопросы, связанные с расширением технических и возрастных границ.
Однако до сих пор возможности хирургического лечения ограничены из-за низкой операбельности и резектабельности, которые, по литературным данным, колеблются всего от 20 до 30,7% (Айтаков З.Н. и соавт., 1996; Трахтенберг А.Х., Чиссов В.И., 2000; Харченко В.П. и соавт., 2000; Давыдов М.И., 2004). Истинная доля выполняемых радикальных операций оказывается еще более низкой, если учесть, что немалое их число производится у больных с нераспознанными метастазами в отдаленные органы (Бисенков Л.Н. и соавт., 1998; Никуличев Л.А., 2000; Трахтенберг А.Х. и соавт., 2005).
С целью повышения эффективности хирургического лечения целесообразным должно быть применение дополнительно к операции других методов противоопухолевого воздействия. Одним из таких направлений комбинированного лечения рака легкого является использование лекарственных противоопухолевых препаратов в различные сроки после выполнения операции, которое получило название адъювантной химиотерапии.
Несмотря на более чем 30-летнюю историю развития методов адъювантной химиотерапии при раке легкого и в настоящее время стандарты применения химиотерапии после радикальных операций еще не разработаны (Гарин А.М., 2003). Основными направлениями, по которым большинством авторов осуществляют попытки повышения эффективности послеоперационной химиотерапии, являются: создание новых, более губительно действующих на опухолевые клетки химиопрепаратов, повышение доз и разработка новых различных комбинаций цитостатиков.
Однако высокая токсичность цитостатиков является серьезным ограничением в достижении максимального лечебного действия и часто не позволяет проводить запланированные курсы лечения в полных дозах.
Одним из перспективных путей улучшения результатов лечения и уменьшения токсического действия химиопрепаратов является разработка новых оптимальных подходов к введению цитостатиков и поиск веществ модификаторов биологического ответа, усиливающих противоопухолевое действие химиопрепаратов. Примером нестандартных способов введения лекарственных веществ являются разработанные в Ростовском НИИ онкологии под руководством академика РАМН Ю.С. Сидоренко методы химиотерапии на естественных биологических средах организма: аутолимфо- и аутогемохимиотерапия (Сидоренко Ю.С., 2002, 2003).
Клинический опыт успешного применения аутогемохимиотерапии при консервативном лечении рака легкого (Карташов С.З., Чилингарянц С.Г., Зинько- вич С.А. и соавт., 2001; Левченко Н.В., 2002; Зинькович С.А., 2005) показывает целесообразность изучения возможностей использования этого метода при адъювантной химиотерапии.
В настоящее время очевидной остается также актуальность поиска и разработки информативных методов для раннего выявления рецидивов и метастазов после операции при раке легкого, критериев для определения режима проведения (продолжительность и количество курсов) послеоперационного противоопухолевого лечения (Бахлаев И.Е., Агеенко А.И., Олейник Е.К., 2002; Харченко В.П., Хмелевский Е.В., 2005).
Оперативное вмешательство и сам факт удаления опухоли, как показано экспериментальными и клиническими исследованиями, ведут к развитию стрессорных реакций, в результате чего происходит ослабление адаптационно-компенсаторных возможностей организма, что оказывает влияние на развитие послеоперационных осложнений, а в дальнейшем на генерализацию опухолевого процесса (Балицкий К.М., Шмалько Ю.П., 1987).
В связи с этим актуальным является поиск способов биологической защиты организма оперированного больного от повреждающего действия хирургического стресса.
С целью формирования антистрессорных реакций возможно использование переменного магнитного поля, принципы применения которого при лечении больных злокачественными новообразованиями были экспериментально разработаны в Ростовском научно-исследовательском онкологическом институте (РНИОИ) (Квакина Е.Б., 1972; Гаркави Л.Х., Квакина Е.Б., 1975; Шихлярова А.И., 2001).
Таким образом, решение всех вышеизложенных проблем требует клинического исследования. Все это определило цель и задачи настоящей работы.
Своевременное распознавание РЛ дает возможность излечить больного. Для этого врач общей практики – семейной медицины должен выработать особое профессиональное психологическое состояние – онкологическую настороженность.
Актуальность проблемы
Рак легких (РЛ) во многих индустриально развитых странах представляет одну из самых актуальных проблем клинической онкологии. Он является наиболее частой злокачественной опухолью и основной причиной смерти от онкологических заболеваний.
Этиология рака легкого
Ни одно из широко распространенных онкологических заболеваний не имеет такой столь очевидной связи с факторами окружающей среды, условиями труда, вредными привычками и индивидуальным стилем жизни, как РЛ. Канцерогенное действие на лёгочную ткань оказывают многие химические вещества: полициклические ароматические углеводороды, входящие в состав продуктов термической обработки угля и нефти (смолы, коксы, газы и др.), ряд простых органических веществ (хлорметиловые эфиры, винилхлорид и др.), некоторые металлы и их соединения.
Существенно загрязняют канцерогенами окружающую среду двигатели внутреннего сгорания и технические выбросы в атмосферу. Особенно опасно сочетание производственных вредностей, экологического неблагополучия с курением табака. Согласно данным американских исследований, у курильщиков, выкуривающих две пачки сигарет в сутки, риск заболеть РЛ в 25 раз выше, чем у некурящих. Рост заболеваемости у женщин также связан с распространением курения, однако не исключено влияние возросшего потребления гормональных препаратов.
Совокупные неблагоприятные воздействия вызывают фоновые предраковые изменения слизистых оболочек бронхов с последующей малигнизацией. Не вызывает сомнения факт малигнизации рубцов после различных воспалительных заболеваний лёгких.
Приведем несколько фамилий известных людей, умерших от рака легкого .
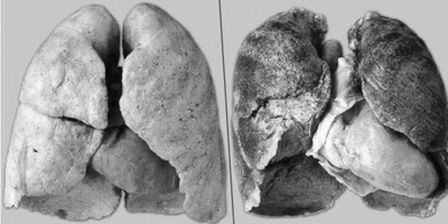
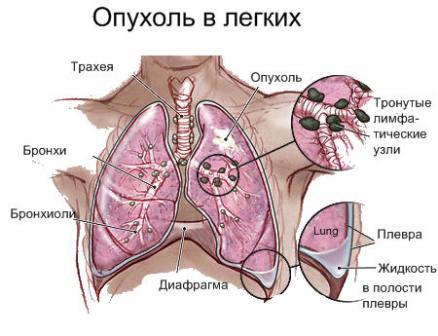
Классификации рака легких
Рациональные классификации рака легких необходимы для планирования алгоритма методов исследования, диагностики распространения процесса, выбора наиболее эффективного метода лечения и прогнозирования отдаленных результатов, т.е. продолжительности жизни больных. Общеприняты три основные классификации:
• Клинико-анатомическая.
• Гистологическая.
• По стадиям болезни (согласно Международной системе TNM).
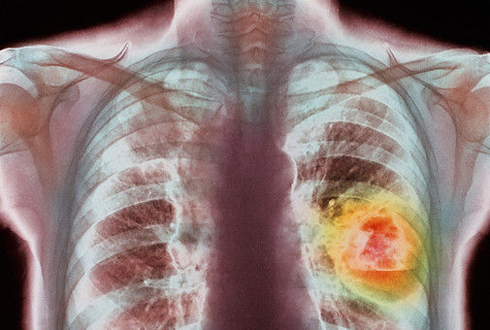
Широкое практическое применение сохраняет клинико-анатомическая классификация РЛ, предложенная А.И. Савицким (1957):
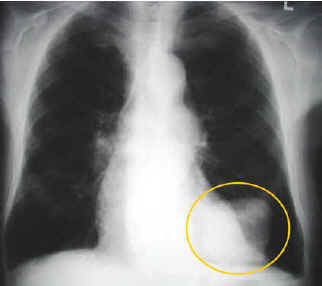
Гистологическая классификация ВОЗ детализирована. В клинической практике выделяют четыре основных варианта строения опухоли:
1. Плоскоклеточный рак.
2. Аденокарцинома (железистый рак).
3. Мелкоклеточный рак.
4. Крупноклеточный рак.
В зависимости от степени дифференцировки опухолевых клеток в каждом варианте различают высокодифференцированные, умереннодифференцированные и низкодифференцированные формы, что очень существенно для прогноза.
Широкое распространение получила упрощенная клинико-морфологическая классификация РЛ, по которой различают рак:
· мелкоклеточный (все низкодифференцированные формы);
· немелкоклеточный (высокодифференцированные формы).
Классификация рака легких по стадиям согласно Международной системе TNM – в настоящее время используется классификация 6-го пересмотра (2002 года). Различают клиническую классификацию до начала лечения (cTNM) и послеоперационную патогистологическую (рTNM). К буквенным символам добавляются цифры, которые определяют распространенность первичной опухоли, степень поражения регионарных лимфатических узлов и наличие отдаленных метастазов (T 0-4, N 1-3, M 0-1). Сочетание этих символов определяют четыре стадии заболевания, из них I, II, III подразделяются на А и В. Различают ещё стадию 0 – скрытый рак, или Cancer in situ.
Развернутый диагноз заболевания должен включать элементы приведенных трёх классификаций, что крайне важно для выбора адекватной лечебной тактики. Пример: Периферический рак верхней доли правого лёгкого, плоскоклеточный, IА стадия, T1 N0 M0. Это означает, что у больного имеется первичная опухоль до 3 см, без метастазов в регионарных лимфатических узлах и отдалённых органах.
Клиника рака легких
Симптоматология, клиническое течение и принципы диагностики при центральном и периферическом РЛ различны, особенно в ранних стадиях заболевания.
К ранним симптомам центрального рака относятся длительный кашель, небольшое кровохарканье в виде прожилок крови в мокроте. Часто больные, особенно курильщики, на эти симптомы не обращают должного внимания. В последующем, по мере увеличения эндобронхиальной опухоли, пораженный бронх суживается, из-за чего развивается эмфизема, гиповентиляция или ателектаз сегмента, доли или всего лёгкого. В лёгочной ткани возникают сопутствующие воспалительные осложнения, появляются слабость, быстрая утомляемость, повышенная температура тела. Заподозрить центральный рак в этом периоде относительно сложно, поскольку больные и врачи, к которым они обращаются, расценивают такое состояние как бронхит, ОРВИ, грипп.
Необходимо оценивать совокупность настораживающих факторов: возраст, профессиональная вредность, курение, наличие онкопатологии в семье и пр.
Кашель, который возникает рефлекторно в самом начале развития опухоли в бронхе, наблюдается у 80-90 % больных. Вначале он сухой, временами надсадный. Позднее, с нарастанием стеноза бронха, появляется слизистая или слизисто-гнойная мокрота.
Кровохаркание, наблюдаемое у половины больных, проявляется в виде прожилок алой крови в мокроте, реже – в виде диффузной окраски. В последствие наступает обтюрация бронха, что рентгенологически выявляется в виде ателектаза сегмента, доли или всего легкого. Эти признаки обтурационного пневмонита являются наиболее характерной чертой в клинической картине центрального рака легкого.
Обтурационный пневмонит имеет ряд типичных черт:
· быстротечность;
· повторяемость;
· развитие на фоне невентилируемой части легкого.
Диагностика рака легких
В своевременной диагностике РЛ, помимо тщательного анализа особенностей течения заболевания и патогенетического подхода к основным клиническим симптомам, решающая роль принадлежит специальным методам исследования. Важнейшее значение отводится морфологической верификации диагноза.
Цитологическое исследование мокроты следует проводить 5–6 раз. Раковые клетки обнаруживают у 52 – 88% больных центральным и у 33–61% периферическим РЛ.
Бронхоскопия позволяет визуально исследовать бронхи и произвести биопсию. Морфологическая верификация диагноза достигается в 98–100% случаев при центральном и в 66% – при периферическом РЛ.
Высокоинформативными являются специальные бронхологические методики: хромобронхоскопия, флуоресцентная бронхоскопия с использованием дериватов гематопорфирина и криптонового лазера, бронхорадиометрия с помощью кремниевых датчиков. Эти методики позволяют выявить рентгенонегативные формы центрального РЛ в самых начальных доклинических стадиях процесса. Методами морфологической верификации периферического РЛ являются трансторокальные (чрезкожные) пункции опухоли легкого под ультразвуковым контролем с цитологическим исследованием пунктата. Диагноз удаётся подтвердить у 83% больных. При диаметре новообразования до 3 см результативность метода составляет около 70%, более 3 см – 85–90%.
Диагностическую торакотомию как последний этап диагностики выполняют у больных с подозрением на РЛ, когда совокупность результатов всех предыдущих исследований не позволяет его подтвердить или исключить. Диагностическая торакотомия менее опасна, чем угроза пропустить РЛ.
Дифференциальная диагностика рака легких
Дифференциальную диагностику РЛ необходимо проводить с большим количеством заболеваний легких, средостения, плевры и грудной стенки. Наиболее часто приходится дифференцировать его с хронической неспецифической пневмонией, нагноительными процессами в легких, туберкулезом, доброкачественными опухолями, паразитарными кистами (эхинококк), очаговым пневмосклерозом, метастазами из других локализаций рака.
Лечение рака легких
Хирургическое лечение больных с резектабельными формами РЛ является радикальным и наиболее обнадеживающим методом, дающим реальные перспективы полного излечения. К настоящему времени разработаны методические и технические аспекты оперативных вмешательств, определены показания к операции, к выбору её объёма, изучены основные вопросы анестезиологического пособия, интенсивной терапии, профилактике и лечению послеоперационных осложнений.
При резектабельных формах немелкоклеточного РЛ (I –III ст.) хирургическое лечение является методом выбора.
Абсолютными онкологическими противопоказаниями к операции на легком являются морфологически подтвержденные метастазы в отдаленные органы, диссеминированное метастатическое поражение плевры со специфическим плевритом, обширное прорастание опухоли в аорту, верхнюю полую вену, пищевод и противоположный главный бронх.
Общесоматическими противопоказаниями признаются низкие компенсаторные возможности дыхания и кровообращения, сердечная недостаточность II – III степени, выраженные органические изменения в сердце, гипертоническая болезнь III степени, почечная или печеночная недостаточность и др.
В оценке противопоказаний всегда присутствует субъективный момент. На необоснованный отказ от хирургического лечения влияют возможности и практический опыт медицинского учреждения. Отказ от операции с онкологических позиций должен быть серьёзно аргументирован.
Стандартными операциями при РЛ являются пневмонэктомия и лобэктомия в различных модификациях.
При РЛ I ст. хирургический метод позволяет добиться излечения 70–80% больных; II ст. – около 60%, а при III ст. – лишь 30–35%.
Послеоперационная летальность в ведущих клиниках составляет 3,2%.
Большинство случаев смерти от рецидива и метастазов приходятся на первые 2–3 года после операции. Если больные благополучно переживают этот критический срок, то могут прожить 15 – 20 лет.
К сожалению, у большинства больных заболевание диагностируют в III и IV стадиях, у многих выявляется тяжелая сопутствующая патология, и их признают не операбельными. Согласно статистическим данным, хирургическое лечение удаётся провести у 15 % больных от общего числа заболевших.
Вторым по эффективности методом лечения РЛ является лучевая терапия (ЛТ). При немелкоклеточном РЛ ЛТ осуществляется по радикальной или паллиативной программе. Радикальная ЛТ предусматривает своим эффектом стойкую стабилизацию процесса с полной регрессией опухоли и метастатически пораженных регионарных лимфатических узлов. ЛТ проводится при помощи дистанционных гамма-установок (дистанционная гамма-терапия, 1,2 МэВ), ускорителей, генерирующих тормозное и электронное излучение энергией 4 – 35 МэВ. С целью усиления действия ионизирующего излучения используются радиосенсебилизаторы, а для снижения радиотоксических эффектов – радиопротекторы. Радикальная доза при Д-Г-Т составляет 60-70 Гр за 30 – 35 фракций.
Непосредственный эффект лучевого лечения зависит от распространенности процесса, гистологической структуры опухоли, величины суммарной очаговой дозы. У половины больных удаётся добиться полной резорбции первичной опухоли и регионарных метастазов, а у 40% – уменьшения внутригрудного опухолевого процесса.
Большим достижением последних лет является фотодинамическая терапия РЛ. Больному вводят туморотропный фотосенсебилизатор, а затем через бронхоскоп облучают очаг лазером определённой длины волны. Московский НИИО им. П.А.Герцена приводит данные о 90 % излеченных больных.
Химиотерапия немелкоклеточного РЛ за последнее десятилетие стала более эффективной благодаря синтезу новых препаратов. Её проводят при противопоказаниях к хирургическому и лучевому лечению в виде 6 – 8 курсов полихимиотерапии. Непосредственное объективное улучшение (частичная резорбция первичной опухоли, регионарных и отдаленных метастазов) достигается при немелкоклеточном РЛ у 10 – 30% больных. Полная резорбция наступает редко. Лучшие результаты достигаются химиолучевым лечением.
Иная ситуация при мелкоклеточном РЛ. Современные схемы химиотерапии или химиолучевого лечения позволяют получить положительный непосредственный эффект у 80 % больных и продлить жизнь 50% больных (Мелкоклеточный рак низко дифференцирован и потому имеет высокий митотический индекс, т.е высокую скорость деления, что делает его чувствительным как к лучевой терапии, так и к химиотерапии. Однако при хорошем локально-региональном эффекте не удается в полной мере предотвратить системного распространения опухолевых клеток гематогенным и лимфогенным путями. Больные погибают от метастазов).
Профилактика рака легких
Согласно терминологии ВОЗ, профилактические мероприятия при РЛ предусматривают первичную и вторичную профилактику.
Первичной профилактикой (онкогигиеническая, иммунобиологическая, законодательная) является система государственных и медицинских мероприятий, направленных на устранение или резкое уменьшение воздействия на организм веществ и факторов, признаваемых в настоящее время канцерогенными и играющих значительную роль в возникновении и развитии злокачественного процесса.
Основной целью онкогигиенической профилактики РЛ является борьба с:
· загрязнением вдыхаемого воздуха или хотя бы уменьшение степени его загрязнения;
· производственными (профессиональными) вредностями;
· курением табака.
Вторичная, или клиническая (медицинская) профилактика предусматривает планово-организационную систему обследования (диспансеризации) населения с целью выявления, учета и лечения фоновых процессов и предопухолевых заболеваний лёгких – факторов повышенного риска РЛ.
К категории повышенного риска относятся пациенты с хроническим бронхитом, пневмонией или туберкулёзом, длительно курящие мужчины 50-ти лет и старше, а также излеченные от злокачественного заболевания. Диспансерное наблюдение с периодическим обследованием этого контингента больных и лечением заболеваний дыхательной системы, которые нарушают механизмы её самоочищения, направлено одновременно на выявление истинно ранних форм РЛ, активное лечение которых даёт хорошие отдалённые результаты. Для своевременного выявления РЛ необходим скрининг групп повышенного риска в условиях диспансеризации – ежегодное качественное флюорографическое либо широкоформатное исследование для выявления периферической формы; цитологическое исследование мокроты и бронхологическое исследование – для центральной.
В заключение важно ещё раз подчеркнуть, что только своевременное распознавание РЛ дает возможность излечить больного. Для этого врач общей практики – семейной медицины должен выработать особое профессиональное психологическое состояние – онкологическую настороженность.
Система онкологической помощи в Украине
Для оказания специализированной онкологической помощи в Украине существует 45 онкологических диспансеров, больниц, центров на 12300 коек. Помощь оказывают 2296 врачей-онкологов и радиологов. В 2003 г. зарегистрировано 155328 первичных онкологических больных. На диагностику и лечение пошло 3 млрд гривен.
60 % больных лечится в специализированных медучреждениях, 40 % – в неспециализированных больницах.
1. Энциклопедия клинической онкологии. Руководство для практикующих врачей. /М.И.Давыдов. М. 2005. 1536 стр.
2. Минимальные клинические рекомендации Европейского общества клинических онкологов (ESMO). Ред. проф. С.А.Тюлядин, проф. Н.И. Переводчикова. М. 2007. Стр.13 – 15.
3. А.Х.Трахтенберг. Проф. МНИО им.П.А.Герцена. Рак легкого (конспект врача). //Новости медицины и фармации в Украине. №10, 2005. Стр. 20 – 23.
4. А.Ю. Попович с соавторами. Современные стандарты лечения рака легкого.//Новоутворення. Науково-практичний журнал Донецького обласного протипухлинного Центру №1, 2007. Стор. 29–32.
5. Я.В. Шпарик. Рак легені. Класифікація, клінічні рекомендації, режими медикаментозної терапії. Львів. Галицька видавнича спілка. 2008. 112 с.
*Дело в том, что немелкоклеточный рак проявляет себя преимущественно как локо-региональный процесс, а химиотерапия – метод преимущественно системного воздействия, и потому при немелкоклеточном раке наиболее эффективны методы локо-регионального контроля: хирургический и лучевой.
Виктор ДАРЧИНОВ
врач-онколог Черкасского онкодиспансера
Читайте также:

