Акриловая кислота с хлором
Акриловая кислота – это один из простейших представителей карбоновых непредельных одноосновных кислот. Ее формула следующая: СН2=СН-СООН. Это бесцветная жидкость, имеющая резкий и неприятный запах. Растворима в воде, хлороформе, диэтиловом спирте и этаноле, с легкостью полимеризуется с дальнейшим образованием полиакриловой кислоты. У акриловой кислоты есть и другие названия: этенкарбоновая кислота и пропеновая кислота.
Как получают (или синтезируют) акриловую кислоту?
1. В настоящее время акриловую кислоту получают посредством парофазного окисления пропилена кислородом (О2) на молибденовых, кобальтовых или висмутовых катализаторах. Примером может служить следующая реакция:
СН2=СН–СН3 (пропилен) + O2 (кислород) = СН2=СН–СООН (кислота акриловая)
2. В прошлом использовалась реакция, при которой взаимодействовали оксид углерода II (СО), ацетилен (СН≡СН) и вода (H2O). Химическая реакция будет при этом такая:
СН≡СН (ацетилен) + СО (оксид углерода II) + Н2О (вода) → СН2=СН–СООН (акриловая кислота).
Еще использовали реакцию формальдегида с кетеном:
СН2=С=О (кетен) + H2C=O (формальдегид) → СН2=СН–СООН (пропеновая кислота).
3. Сейчас фирмой Rohm and Haas создается особая технология синтеза кислоты этенкарбоновой из пропана.
Химические свойства акриловой кислоты
Рассматриваемая нами кислота может образовывать соли, сложные эфиры, ангидриды, амиды, хлорангидриды и другие соединения. Также она может вступать в реакции присоединения, которые характерны для этиленовых углеродов. Присоединение воды, протонных кислот и NH3 происходит не по правилу Марковникова. При этом образуются замещенные производные. Акриловая кислота участвует в синтезе диенов. Также конденсируется с различными солями арилдиазония. При ультрафиолетовом облучении она образует полиакриловую кислоту.
Применение акриловой килоты
– используется в качестве сырья в производстве широкого ассортимента полимерных продуктов с различными химическими и физическими свойствами (например, пластика и покрытий);
– применяется в производстве дисперсий для акриловых водных лакокрасочных материалов; при этом область применения таких красок будет зависеть от химических свойств сополимера – от окончательной окраски транспортных средств и до покраски потолков;
– акриловая кислота и ее производные используются для создания пропитки для кожи и тканей, эмульсий к лакокрасочным материалам, в качестве сырья для акрилатных каучуков и волокон полиакрилонитрильных, строительных клеев и смесей; сложные эфиры метаакриловой и акриловой кислот (в большинстве случаев используются эфиры метиловые метилметакрилат и метилакрилат) применяются в производстве полимеров;
- часто акриловая кислота используется в создании суперабсорбентов.
Правильное хранение акриловой кислоты
При хранении данного вещества в целях избегания полимеризации добавляют ингибитор – гидрохинон. Перед использованием кислоту необходимо перегонять с осторожностью, так как возможно развитие взрывоподобной полимеризации.
Безопасность при использовании
При работе с акриловой кислотой следует учесть, что данное вещество оказывает раздражающее действие на кожные покровы и слизистые оболочки. Порог раздражающего действия кислоты составляет 0,04 мг/литр. При попадании на слизистую оболочку глазных яблок, как правило, вызывает сильнейшие ожоги роговицы, может привести к необратимым изменениям (повреждениям, не поддающимся лечению). Вдыхание паров акриловой кислоты может вызвать головную боль, раздражение дыхательных путей, а в чрезмерных дозах – развитие отека легких. В помещениях, где проводится работа с акриловой кислотой, необходим постоянный контроль воздуха. ПДК данной кислоты составляет 5 мг/метр³. Меры безопасности надо соблюдать и при работе с другими производными. Как пример можно привести нитрил акриловой кислоты.
АКРИЛОВАЯ КИСЛОТА (пропеновая кислота, этиленкарбоновая кислота) CH2=CHCOOH
мол. м. 72,06; бесцветная жидкость с резким запахом; т. пл. 12–13,5 °C, т. кип. 140,9–141,6 °C, 65 °C/30 мм рт. ст.; d 20 41,0511, n 20 D 1,4224; Cv2,76 кДж/(кг∙К) при 25 °C, давление пара 4,13 гПа при 20 °C; ΔH 0 обр −384,6 кДж/моль, ΔH 0 сгор-1,370 МДж/моль, теплота парообразования 45,6 кДж/моль; К 5,6∙10 −5 (25 °C). Раств. в воде, спирте, CHCl3, бензоле. При хранении полимеризуется, ингибитор-гидрохинон. Соли и эфиры А.к. наз. акрилатами.
А. к. обладает хим. свойствами, присущими карбоновы.и кислотам: образует соли, хлорангидриды, ангидриды, сложные эфиры, амиды и пр. Она также вступает в реакции присоединения, характерные для этиленовых углеводородов. При действии амальгамы Na в водном растворе и гидрировании в жидкой фазе в присутствии Ni, Pt, Pd А. к. превращ. в пропионовую кислоту, в среде ДМСО гидродимеризуется. Присоединение протонных кислот, воды и NH3 происходит против правила Марковникова с образованием
замещенных производных. Как диенофил А. к. участвует в диеновом синтезе. Конденсируете^ с хлористыми и бромистыми солями арилдиазония (реакция Меервейна): n-ClC6H4N2Cl +
CH2^CHCOOH 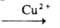
n-С1C6H4CH=CHCOOH
+ HCl + N2. При УФ-облучении или в кислых водных растворах (рН
1) образует полиакриловую кислоту [—CH2—СН(COOH)—]n. Сплавление с KOH приводит к уксусной и муравьиной кислотам.
Методы получения А.к.: парофазное окисление пропилена кислородом воздуха на висмутовых, кобальтовых или молибденовых кат. через стадию образования акролеина; гидрокарбоксилирование ацетилена:
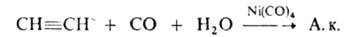
взаимод. этиленхлоргидрина с KCN (HCN) с послед. гидролизом образовавшегося этиленциангидрина при 160 °C в присутствии водного раствора H2SO4; окисление акролеина кислородом воздуха в присутствии ванадиевых кислот (HVO3, H4V2O7) при 20–34 °C; взаимод. по реакции:
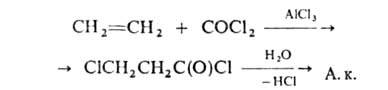
А. к. применяется в производстве полиакриловой кислоты, ионообменных смол, каучуков, эфиров, бутил-, трет-бутил-, изобутил-, метил- и этилакрилатов, этиленгликольмоноакрилатов.
А. к. раздражает слизистую оболочку глаз (порог раздражающего действия 0,04 мг/л); ПДК 5 мг/м 3 . Корродирует металлы. Т. всп. 54,4 °C, т. воспл. 155,3 °C.
Акриловая кислота и некоторые сведения об этом ядовитом веществе. Это химическое соединение принято называть также пропеновой или этекарбоновой кислотой .
Она вредна для здоровья , даже взрывоопасна. Свойствам кислоты , а также мерам безопасности при её хранении посвящается данная статья .
Свойства акриловой кислоты
На вид кислота представляет из себя самую обычную бесцветную жидкость, но обладающую очень неопрятным, отвратительным и резким запахом.
А с точки зрения науки химии представляет из себя простейший тип непредельных одноосновных карбоновых кислот . Температура кипения этого жидкого соединения 141 °C.
Формула акриловой кислоты выглядит следующим образом: СН2 = СН — СООН. Жидкость легко реагирует с мономерами, при этом образуются сополимеры.

Раствор акриловой кислоты можно приготовить не только в таком идеальном растворителе, как водная среда, но и в этаноле, диэтиловом спирте, хлороформе и многих органических веществах.
Кислота способно образовывать сложные эфиры акриловой кислоты. Метилакрилат или метиловый эфир, а также аллилакрилат и этилакрилат впервые были получены более ста лет назад в результате отщепления брома цинком от эфира α,β-дибромпропионовой кислоты .
А в начале прошлого века школа Штаудингера выпустила в свет ряд публикаций с исследованиями по теме: полимеры акриловой кислоты.
В этой области свойства акриловой кислоты продолжают использоваться и в настоящий период.
Кроме того, вещество способно образовывать хлорангидриды, по большей части представляющие из себя жидкости; амиды – соединения органического, а также неорганического характер; ангидриды – производные кислородных кислот ; соли и прочие разнообразные соединения.
Описываемая ядовитая бесцветная жидкость может проявлять свойства этиловых углеродов , вступая в особую реакцию присоединения с водой. Акриловая кислота способна также присоединять аммиак и протонные кислоты .
Это легко воспламеняющееся, летучее вещество. И именно в этом его коварство и опасность.
Пары кислоты способными вспыхивать и возгораться даже на расстоянии достаточно удалённом от места её нахождения.
Бывали случае, когда при неправильном хранении вещество воспламенялось и при комнатной температуре.
В присутствии кислорода опасная жидкость легко полимеризуется, чем и объясняется его взрывоопасность.
Производство акриловой кислоты
За прошедшие сто лет вещество научились добывать несколькими способами. В прошлом взрывоопасную жидкость получали посредством химического взаимодействия кетена, неприятно пахнущего, бесцветного газа, с формальдегидом. Подобную реакцию можно описать следующим образом:
А также, получение акриловой кислоты производилось с помощью реакции с участием оксида углерода – бинарного химического соединения, ацетилена – бесцветного газа и обыкновенной воды. С помощью химических формул это взаимодействие можно записать так:

Кроме того, широко применяется технологический способ, предполагающий использование каталитического парофазного окисления горючего газа пропилена при взаимодействии с кислородом с использованием самых разнообразных катализаторов, то есть веществ, которые сами не участвуют в ходе взаимодействия, но ускоряют саму реакцию. Данный процесс описывает следующая формула:
Ввиду опасности акриловой кислоты, хранение её требует особых мер, чтобы исключить её полимеризацию, способную спровоцировать взрыв жидкости.
Для этого в кислоту добавляют особое вещество: ингибитор – гидрохинон. Перед применением следует перегонять кислоту , соблюдая особые меры осторожности.
Применение акриловой кислоты
Вещество и его производные используется, как сырьё для изготовления множества разновидностей полимерной продукции с самым широким набором физических и химических свойств, различных покрытий и пластика.
Применение акриловой кислоты касается также производства красителей и лаков, использующихся для ремонта помещений и покрытия различных поверхностей, в том числе легковых машин и других транспортных средств акриловыми красителями.

Вещество применяется для изготовления полимеров, клеев, смесей, пропитки для тканей и кожи .
С помощью ледяной акриловой кислоты создаются вещества с интересными свойствами, способные впитывать жидкость в объёме, превышающем собственный вес и называемых суперабсорбентами.
Такие качества веществ оказались очень полезными в быту. Они с успехом используются в производстве средств гигиены и подгузников, необходимых и удобных для женщин и детей .

Соли акриловой кислоты и их растворы используется при производстве литейных форм, герметизации нефтяных скважин и защиты почв от эрозии.
Сополимеры акриловых кислот являются основой для лаков и клеев и улучшают стойкость вещества к растворителям.
Вещество является настоящей находкой для маникюрщиков и косметологов. И очень помогает женской половине человечества в том, чтобы выглядеть неотразимо.
Косметика и гели, изготовленные из полимерных основ кислоты , прекрасно ложатся на кожу.
Правда, следует заметить, что многие довольно активно высказывают сомнения в их полной безвредности для состояния здоровья .
И это неприятное качество подобной продукции породило много споров и дискуссий по такому животрепещущему вопросу.
Цена акриловой кислоты
Производство кислоты постоянно возрастает, исчисляясь по всему миру в размере нескольких миллионов тонн в год.
А также ежегодно строятся новые предприятия и комбинаты соответствующего профиля в России , что делает приобретение вещества для предполагаемых покупателей вполне доступным.
Чтобы узнать: где и по каким ценам есть возможность купить акриловую кислоту, целесообразно воспользоваться подходящим сервером в Интернете .
Там вероятно найти выгодные предложения с адресами, фотографиями, описанием и отзывами.
Дешёвую акриловую кислоту можно приобрести по каталогу или подыскать подходящий магазин , совершив выгодную сделку.
Многие предприятия и фирмы занимаются также доставкой, которая может быть произведена в любую точку России .
При приобретении кислоты следует учитывать её опасность и вредные свойства.
Само вещество, а также производные акриловой кислоты, крайне пагубно воздействует на слизистую оболочку и кожные покровы, раздражая их.
Хранить кислоту следует в концентрации, не превышающей 0,04 миллиграмм на литр.
А содержание паров вещества в воздухе не должно быть больше 5 миллиграмм на кубический метр.
Не следует хранить ядовитую жидкость в стеклянных бутылках или банках, которые легко могут разбиться, а вещество нанести вред безопасности.
При попадании в глаза акриловая кислота способна вызывать серьёзные ожоги, которые могут привести к сильнейшим травмам роговицы и ухудшению, а при большой концентрации кислоты , даже полной потере зрения.

Вредно также дышать парами вещества, вызывающими раздражение и губительно действующими на многие органы, но более всего на систему дыхания.
Нахождение в помещении с ядовитыми парами может привести к головным болям, а в особо неприятных случаях – к отёку лёгких.
В помещениях, где храниться и используется это вещество, а также его производные (к примеру нитрил акриловой кислоты), следует соблюдать строжайшие меры безопасности.
Оптовая цена акриловой кислоты составляет приблизительно 115-180 руб. за килограмм.
Товар продаётся, перевозится и хранится в стальных бочках ввиду его особой опасности.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg + | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | Р | Н | ? | Н | Н | ? | Р | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | ? | ? | ? | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (  Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса " " содержит ошибку, нажмите на кнопку "Отправить". Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений.
Здесь, возможно, указаны не все изомеры данного вещества. Более полный поиск изомеров следует проводить по формуле. Например, чтобы получить изомеры вещества с формулой С6H10O6 , следует сделать запрос так: Изомеры - это соединения с одинаковым количественным составом (то есть одинаковым числом атомов каждого элемента), но разным строением. Читайте также:
|

