Установка лазерная для флуоресцентной диагностики опухолей

БЕСПЛАТНАЯ КОНСУЛЬТАЦИЯ: поможем врачам и владельцам клиник выбрать аппарат для флуоресцентной дерматоскопии
Раннее выявление предраковых состояний кожи и злокачественных новообразований критически важно для их успешного лечения. В диагностике врачи применяют различные инструменты, наиболее востребованным среди которых является дерматоскоп.
Решить эти проблемы призвана флуоресцентная дерматоскопия, о которой мы расскажем в статье.
От терапии к диагностике
В начале 1900-х годов врачи стали использовать розовый краситель эозин для лечения различных кожных патологий: простого герпеса, контагиозного моллюска, псориаза и некоторых опухолей.
Сегодня в фотодинамической терапии обычно применяется 5дельта-аминолевулиновая кислота (сокращенно 5-ALA или просто ALA), либо ее метиловый эфир (MAL). Механизм действия этих веществ основан на внутриклеточном превращении ALA в протопорфирин IX, который под действием света вызывает образование в клетках избытка активных форм кислорода, что приводит к их апоптозу – это так называемая фототоксическая реакция. Максимальный эффект зафиксирован на длине волны 360-400 нм, более слабые – между 500 и 635 нм (рис. 1).

Рис. 1. Спектр абсорбции молекул порфиринов (адаптация из Fritsch C., Ruzicka T. Fluorescence diagnosis and photodynamic therapy of skin diseases. Springer-Verlag Wien 2003)
Максимум поглощения света находится в так называемой полосе Сорэ – на уровне 405 нм. Чуть меньшие пики наблюдаются при 505, 540, 580 и 630 нм.
Идея фотодинамической терапии развивалась, и постепенно из нее выделилось отдельное направление – флуоресцентная диагностика.
Селективная флуоресценция новообразований
Флуоресцентная диагностика сегодня применяется для раннего выявления предраков и немеланоцитарных опухолей кожи, а также точного определения их границ в пределах тканей. На первый взгляд, флуоресцентная диагностика похожа на ALA-PDT терапию – здесь также наносится 20% крем аминолевулиновой кислоты под окклюзию. Опухолевые клетки селективно накапливают ALA, в результате чего в них активируется синтез порфиринов. Однако в деталях это разные процедуры – например, опухолевые клетки при флуоресцентной диагностике не погибают, а только светятся при облучении определенными длинами волн. Сейчас мы кратко объясним принцип этого явления.
Когда свет падает на любую среду, часть его отражается, часть поглощается средой, а часть проникает в нее. Поглощенная световая энергия стимулирует переход молекул порфиринов на более высокий энергетический уровень. Здесь они находятся непродолжительное время и стремятся вернуться обратно. При переходе на базовый уровень порфирины выделяют часть энергии в окружающую среду в виде света (рис. 2). Интенсивность свечения пропорциональна интенсивности входящего излучения и концентрации флуоресцирующего вещества.
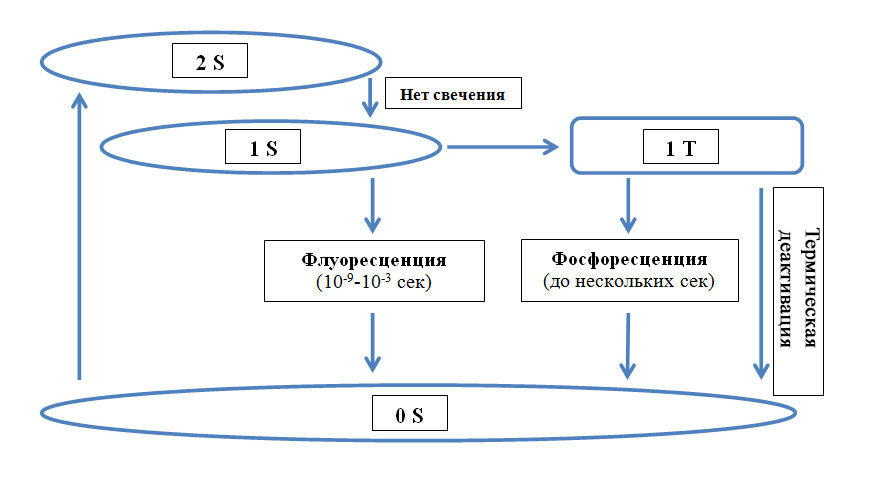
Рис. 2. Энергетические уровни молекул порфиринов, использующихся в качестве фотосенсибилизаторов (адаптация из Fritsch C., Ruzicka T. Fluorescence diagnosis and photodynamic therapy of skin diseases. Springer-Verlag Wien 2003)
В норме молекулы порфиринов находятся на базовом уровне 0S. Свет провоцирует их переход на более высокие энергетические уровни, где они находятся непродолжительное время и стремятся вернуться обратно. Возврат на 0S сопровождается флуоресценцией. Кроме того, порфирины могут перейти на другой высокоэнергетический уровень – 1Т, возврат с которого занимает больше времени и сопровождается фосфоресценцией.
Явление излучения порфиринами света называется люминесценцией. Если люминесценция быстро исчезает (за 10 -9 -10 -3 сек), ее называют флуоресценцией, а если остается на продолжительное время (вплоть до нескольких секунд) – фосфоресценцией. На этих эффектах основана современная флуоресцентная диагностика предраков и немеланоцитарных опухолей кожи.
Чтобы добиться флуоресценции, исследуемая область облучается ультрафиолетом с длиной волны 370-405 нм – например, лампой Вуда. Для фотодинамической терапии используют зеленый (545 нм), красный (635 нм) или голубой лазер (410 нм). После обработки ALA фотосенсибилизация кожи сохраняется вплоть до 2 дней, поэтому пациенту следует быть осторожным и защищать указанную зону от света.
Флуоресцентная диагностика должна выполняться перед любыми сеансами фотодинамической терапии, поскольку новообразование может занимать более обширную площадь по сравнению с его внешним видом (принцип айсберга). Это позволит определить реальные размеры опухоли и распространение неопластического процесса в тканях.
Высокоточная диагностика с FotoFinder FDlens
FotoFinder FDlens – это уникальная линза для флуоресцентной диагностики предраков и немеланоцитарных новообразований кожи: базально-клеточной и сквамозно-клеточной карциномы, актинического кератоза и других патологий. Она полностью совместима с видеодерматоскопами medicam 800HD и medicam 1000, монтируясь вместо стандартной линзы.
FotoFinder FDlens оснащена специальной тубой, которая полностью охватывает новообразование и блокирует внешний свет. Таким образом врач может внимательно осмотреть подозрительный участок кожи даже в яркий солнечный день – и для этого ему не потребуется затемнять помещение. В комплект также входит специальная накидка из светонепроницаемого материала – она позволяет выполнять обзорные снимки выбранных областей на расстоянии.
В FotoFinder FDlens встроены источники голубого и белого света – это дает возможность врачу быстро переключаться между флуоресцентной и визуальной диагностикой. В итоге дифференцировать опухоли становится намного проще.
Линза FDlens полностью совместима с цифровыми дерматоскопами medicam 800HD и medicam 1000. Они обладают широчайшими диагностическими возможностями, которые рассмотрим на примере FotoFinder medicam 1000:

Центр является признанным лидером в российском здравоохранении в разработке новых методик фото диагностики и фотодинамической терапии онкологических заболеваний

Пациенты из любого региона РФ
ОМС, талон на ВМП

Руководитель Центра, врач-онколог, д.м.н, профессор, Елена Вячеславовна Филоненко
Задать вопрос врачу
Оставьте заявку и получите консультацию нашего специалиста
Основные направления деятельности Центра лазерной и фотодинамической диагностики и терапии опухолей Минздрава России

Данное изображение позволяет оценить каждое пигментное новообразование и, в соответствии с разработанной в отделении рабочей классификацией оценки спектрофотометрического изображения, на доморфологическом этапе определить доброкачественное пигментное образование, диспластический пигментный невус, меланому кожи. Использование данного метода позволяет неинвазивно диагностировать меланому кожи с чувствительностью - 96%, специфичностью 99%, диагностической точностью 99%.
Наиболее сложная для дифференциальной диагностики доброкачественного и злокачественного опухолевого поражения кожи является группа больных с множественными образованиями кожи неуточненной морфологической структуры. Применяемый в отделении неинвазивный метод флуоресцентной диагностики (ФД) позволяет исследовать кожные покровы человека тотально, а также прицельно выявленное новообразование. ФД проводится с целью: определения границ опухолевого поражения перед проведением специализированного противоопухолевого лечения (курс ФДТ, хирургическое лечение); поиска скрытых очагов первичного и/или рецидивного рака кожи и слизистой оболочки органов различной локализации; инраоперационная ФД при хирургическом лечении рака различной локализации с целью определения объема резекции тканей (определение границ опухолевого поражения).
Аппаратурным обеспечением при проведении ФД являются: диодный источник света с синим фильтром (длина волны 385-460нм), очки или специальной оборудование со светофильтрами, флуоресцентная фотокамера, диагностическое устройство для проведения флуоресцентной диагностики со встроенной видеокамерой, лазерная электронно-спектральная установка позволяющая локально определять степень накопления фотосенсибилизатора в любых органах пациента, доступных для волоконно-оптического зонда; эндоскопическая флуоресцентная аппаратура и флуоресцентные микроскопы различных фирм. Методика ФД успешно применяется при проведении специализированного противоопухолевого лечения рака кожи, слизистых оболочек, метастатического поражения головного мозга, рака щитовидной железы, злокачественных новообразований органов грудной и брюшной полости и др.


Фотодинамическая терапия (ФДТ) – метод противоопухолевого лечения, обладающий высокой эффективностью и практически не имеющий побочных эффектов и осложнений. Метод основан на способности ряда лекарственных препаратов – фотосенсибилизаторов селективно накапливаться и удерживаться в ткани злокачественных опухолей. Под действием энергии лазерного излучения в сенсибилизированных клетках и тканях развиваются фотохимические реакции с выделением синглетного кислорода и свободных радикалов, что приводит к гибели и разрушению опухолевых клеток без негативного влияния на здоровые ткани и органы. ФДТ не сопровождается токсическими эффектами, осложнениями и может быть повторно проведена в зоне предшествующего лечения.
Современные направления использования ФДТ в онкологии очень часто применяются в комбинации с лучевой терапией, хирургическим лечением, химиотерапией, что позволило не одной тысяче больных получить эффективную высокотехнологичную медицинскую помощь.
| Рассчитана на полное излечение, при ранних стадиях рака кожи, меланомы, нижней губы, языка, слизистой оболочки полости рта, трахеобронхиального дерева, желудка, пищевода, мочевого пузыря и других органов в качестве альтернативы лучевому и хирургическому методам лечения, при высоком риске оперативного вмешательства или невозможности его выполнения по иным причинам. |
| Этот метод противоопухолевого лечения обладает высокой эффективностью и практически не имеет побочных эффектов и осложнений при лечении перитонеального карциономатоза. Метод основан на способности ряда лекарственных препаратов – фотосенсибилизаторов селективно накапливаться и удерживаться в ткани злокачественных опухолей. Под действием лазерного излучения определенной длины волны в сенсибилизированных клетках и тканях развиваются фотохимические реакции с выделением синглетного кислорода и свободных радикалов, что приводит к гибели и разрушению опухолевых клеток при минимальном воздействии на здоровые ткани и органы. |
| Рак кожи, рак верхней и нижней губы, рак полости рта и языка, рак вульвы, центральный рак легкого, рак желудка и пищевода, метастазы рака молочной железы в кожу, метастазы меланомы в кожу, саркома Капоши, атрофическая дистрофия вульвы (крауроз вульвы) |
| в сочетании с методами комбинированной терапии у больных III-IV стадией онкологического заболевания различной диссеминации: меланома, рак яичников, рак молочной железы, рак легкого, злокачественные новообразования желудочно-кишечного тракта и плевры. |
| Для реканализации пищевода и желудка, трахеи, крупных бронхов, желчных протоков при далеко зашедших процессах, опухолевых стенозах, а также при некоторых метастатических поражениях. |

Индивидуальный подход к каждому пациенту — залог эффективности в работе Центра лазерной и фотодинамической диагностики и терапии опухолей Минздрава России

При этом, пациентам, госпитализированным в стационар МНИОИ им. П.А. Герцена комплекс реабилитационных мероприятий, начинают выполнять уже на этапе подготовки к хирургическому лечению, затем в раннем послеоперационном периоде. Далее, при наличии показаний курсовое лечение проводят после завершения специализированного противоопухолевого лечения и выписки больного из стационара.
- применение физических факторов с целью лечения лучевых воспалительных реакций и повреждений кожи и слизистых оболочек;
- применение физических факторов для лечения локальных осложнений лекарственной противоопухолевой терапии (флебит)
- применение физических факторов для профилактики и лечения гнойно-воспалительных послеоперационных осложнений (рис. 6);
- применение физических факторов с целью предупреждения гемодинамических расстройств в пересаженных тканях и улучшение функциональных результатов при реконструктивно-пластических операциях.
На II этапе реабилитации:
- разработка и внедрение комплексных методик реабилитации больных с постмастэктомическим отеком верхней конечности (рис. 7);
- разработка и внедрение комплексных методик реабилитации больных с отеком нижней конечности после хирургического лечения сопровождавшегося расширенной лимфаденэктомией у пациентов онкогинекологического и онкоурологического профиля;
- разработка и внедрение комплексных методик реабилитации больных с постлучевым циститом и/или ректитом;
- применение физических факторов с целью профилактики и купирования явлений пареза нерва.

Ключевые преимущества
- Безболезненное воздействие
- Нет необходимости в реабилитации
- Удобное положение во время операции
- Лечение опухолей любой локализации
- Нет необходимости в
анестезии - Лечение инфаркта и ишемической болезни сердца
- Пациент свободно дышит и удобно лежит во время исследования
- Без разрезов и шрамов
- Селективное разрушение злокачественных новообразований, что обеспечивается избирательным накоплением предварительно введенного фотосенсибилизатора и локальному воздействию лазерного облучения определенной длины волны
- Возможность одновременного проведения диагностических и лечебных процедур
- Широкое поверхностное воздействие без выраженного поражения подлежащих тканей, что позволяет получить наиболее благоприятные функциональные и эстетические результаты
- Лечение методом ФДТ может проводиться повторно и многократно в отличие от хирургического вмешательства или лучевой терапии
- Непродолжительный срок лечения (пребывание в стационаре 3-5 суток)
- Отсутствие системных токсических и иммунодепрессивных реакций
- Хорошая переносимость ФДТ позволяет использовать данный метод лечения у пожилых пациентов и у больных с тяжелой сопутствующей патологией, у которых применение традиционного лечения сопровождается высоким риском развития осложнений.
- Лечение пациентов из любого региона РФ, ближнего и дальнего зарубежья
- Создан экспериментальный прототип акустооптической гиперспектральной системы с возможностью пространственной фильтрации и оконтуривания изображений.
- Создан лазерный драйвер фотокатодов для инжекции электронов с акустооптической системой управления ультракороткими лазерными импульсами.
- Исследования в области акустики и оптики анизотропных сред позволили определить оптимальные конфигурации широкоапертурных и квазиколлинеарных акустооптических фильтров на основе монокристаллов парателлурита.
- Проведены гиперспектральные исследования флуоресцентного излучения опухолевых тканей щитовидной железы человека.
- Разработаны методы формирования произвольных спектральных функций пропускания акустооптических фильтров.
- Фемтосекундный лазер Femtosource Synergy (Femtolasers, Австрия).
- Фемтосекундный автокоррелятор Femtometer (Femtolasers, Австрия).
- Усилитель регенеративный RAP-2000 (Авеста-проект, Россия).
- Система диагностики ультракоротких лазерных импульсов MIIPSBox-640 (Biophotonic Solitions, США).
- Генератор сигналов произвольной формы N8241A (Agilent, США).
- Генератор сигналов произвольной формы 33622А (Keysight, США).
- Оптический анализатор спектра 86142В (Agilent, США).
- Аргоновый лазер 488 нм (Melles Griot, США).
- Твердотельный лазер 532 нм (Laser Quantum, Великобритания).
- ВЧ-усилители (Amplifier Research, США).
- Анализатор спектра радиосигналов FSH3 (Rhode&Schwarz, Германия).
- Измеритель мощности радиосигналов NRT-Z14 (Rhode&Schwarz, Германия).
- Рентгеновский дифрактометр (Rigaku, Япония).
- Автоматизированная установка для резки кристаллов и пластин APD2 (Logitech, Великобритания).
- Шлифовально-полировальный оптический станок OLP 200/C (AKM, Германия).
- Интерферометр OptoTL-60 (Оптико-технологическая лаборатория, Россия).
- Ультразвуковая линия отмывки (Selecta, Испания).
- Установка вакуумного напыления (Torr, США)
- Установка термокомпрессионной сварки (Kulicke&Soffa, США).
- Векторный анализатор цепей E5061A (Agilent, США).
- Микроскоп медико-биологический Ti-E (Nikon, Япония).
- Гиперспектральная система HSi-300 (Gooch & Housego, США).
- Охлаждаемая ПЗС-Камера Alta U32 (Apogee Instruments, США).
- Прецизионные оптические столы (Thorlabs, США).
- Оптическая станция (Thorlabs, США).

Ключевые преимущества применения лазерной и фотодинамической терапии в лечении онкологических заболеваний

Процесс подготовки и лечения
Междисциплинарный консилиум врачей на до госпитальном этапе
Выполнение необходимых диагностических исследований.
Госпитализация и операция
Фотогалерея отдела









Для пациентов
Гордость отдела – высококвалифицированные специалисты!
На базе отделения
проходит обучение и подготовка врачей, аспирантов и ординаторов. Отделение тесно сотрудничает с ведущими российскими онкологическими диспансерами и центрами.
Современные методы диагностики и лечения!
Всесторонняя
помощь онкологическим больным проводится благодаря работе научных и исследовательских кафедр, наличию первоклассного оборудования и специалистов в лечении и диагностировании рака.
Информация о пациенте
1. Жалобы пациента.
2. Диагноз, если он уже установлен.
3. Данные о проведенном ранее лечении и обследованиях..
4. Гистологическое заключение.
5. Анализы.
Можно ли провести лечение по ВМП (квоте)?
Лечение значительной части заболеваний, можно провести по ОМС и ВМП (квоте).
О Центре

Для решения вопроса о лечении в Центре лазерной и фотодинамической диагностики и терапии опухолей Минздрава России необходимо обратиться в информационно-контактный центр и получить направление в поликлинику для консультации с врачом. Возможно будет назначено обследование или до-обследование, после чего будет проведен консилиум с участием врачей хирургов, онкологов и химиотерапевтов, на котором будет выбран метод противоопухолевого лечения. Необходимо помнить, что лечение при злокачественных новообразованиях выполняется по ОМС или талонам ВМП (высокотехнологичная медицинская помощь) и финансируется из государственного бюджета. Получить талон на ВМП можно непосредственно в поликлинике МНИОИ им П.А. Герцена. Позвоните нам сегодня, чтобы мы смогли Вам помочь! 8 495 150 11 22
История подразделения берет свое начало с 1965 года, когда в Институте медицинской радиологии АМН СССР было открыто хирургическое отделение. Возглавила его замечательный человек и хирург, участница Великой Отечественной войны, ученица А.А. Вишневского, доктор медицинских наук, профессор Прасковья Павловна Фирсова.
Прасковья Павловна была наставником и руководителем целого поколения ученых и врачей, впоследствии ставших профессорами и заведующими отделениями, ей присвоено звание "Заслуженный деятель науки РСФСР". Талантливый ученый и новатор, автор 7 изобретений, совершенствующих технику операций на легком и средостении, П.П. Фирсова большое внимание уделяла повседневной работе в отделении. Ее школу отмечает бережное и чуткое отношение к больным.
С 1988 по май 2012 гг. отделением руководил Виктор Николаевич Медведев, продолживший научную и практическую деятельность по разработке и изучению новых методов комбинированного и комплексного лечения рака легкого и рака молочной железы.
С мая 2012 по май 2018 г.г. отделением руководил к.м.н. Юрий Александрович Рагулин. За эти годы в отделении научная и практическая деятельность были продолжены, а также апробированы и внедрены методики интраоперационной лучевой терапии, фотодинамической терапии, лазерной хирургии, внедрены методики малоинвазивных операций. Научная и практическая работа по указанным направлениям продолжается и в настоящее время.
С мая 2018 г. отделением заведует к.м.н. Сергей Викторович Гамаюнов. Продолжается развитие комбинированного и комплексного лечения опухолей легкого, пищевода и желудка, подходы к малоинвазивным методам диагностики, персонификация терапии, внедрение молекулярно-генетических исследований.
Под катом Вы найдете много информации о проекте, оборудовании, уникальности исследования. Мы подготовили фоторепортаж, который описывает систему гиперспектрального анализа и лазерного исследования микроскопических препаратов и раскрывает её значение.
Своей основной целью лаборатория ставит создание новых акустооптических систем гиперспектральной лазерной флуоресцентной диагностики онкологических заболеваний и акустооптических приборов для фемтосекундных лазерных комплексов адронной терапии онкологических заболеваний. Данный проект представляет уникальное сочетание современных разработок в области оптики и лазерной физики с применениями в биомедицинской области (онкологии). Актуальность поставленных задач обусловлена направленностью на создание ключевых компонентов нового поколения установок адронной терапии онкологических заболеваний, основанных на компактных лазерных источниках и ускорителях заряженных частиц высоких энергий. Также в проекте решается задача формулирования новых диагностических критериев при дифференциальной диагностике и определении злокачественности опухолей человека.
Результаты, которые были достигнуты коллективом лаборатории:
Оборудование:
Система гиперспектрального анализа и лазерного исследования микроскопических препаратов
Гиперспектральный анализ заключается в получении и массива изображений исследуемого объекта на различных длинах волн и последующем изучении спектральных особенностей различных фрагментов изображения. Основы технологии гиперспектрального анализа, называемые также спектрозональной съемкой, были разработаны для решения задач астрофизики, космических исследований и дистанционного зондирования Земли. В последние годы эти методы стали внедряться и в биомедицинских исследованиях, в частности в диагностика рака. Получаемый при гиперспектральном анализе объем информации об объекте существенно превосходит цветные изображения: спектральное разрешение современных гиперспектральных систем составляет несколько сот линий в видимом диапазоне спектра, в то время как цветная (RGB) камера выделяет только три широких спектральных диапазона (красный, зеленый и синий). Одним из физических приборов, позволяющих реализовать спектрометр изображений, являются перестраиваемые акустооптические фильтры.

Система построена на базе инвертированного микроскопа Nikon Ti-E с набором объективов от 4× до 100х


Исследуемые образцы – препараты цитологических мазков и гистологических срезов опухолей человека на высокоточном моторизированном XY-столике микроскопа

*Стандартный метод микроскопического исследования – просвечивание образца белым светом (галогенная лампа, штатный конденсор микроскопа)
Наблюдаемое при этом изображение объекта содержит информацию о спектральных кривых пропускания образца, которая, однако, теряется при регистрации обычной ПЗС-камерой. Кроме того, при наблюдении объекта в белом свете можно увидеть только амплитудную модуляцию, то есть различие между более и менее прозрачными фрагментами изображения. Фазовая модуляция, обусловленная вариациями толщины образца или его показателя преломления, может быть визуализирована только в когерентном освещении и с помощью специальных систем пространственной фильтрации. Один из классов таких систем – акустооптические фильтры изображений, неоспоримым достоинством которых является адаптивность, то есть возможность изменять характеристики в ходе эксперимента в зависимости от поставленной задачи.

Излучение красного лазера направляется в коллиматор, который позволяет по одномодовому оптоволокну передать освещение на объект

Лазерный осветитель препарата состоит из свободного окончания оптоволокна и линзы с фокусным расстоянием 100 мм. После линзы формируется практически плоский фронт световой волны, что позволяет исследовать фазовую структуру объектов

В боковом порту микроскопа формируется увеличенное изображение объекта, которое и подвергается дальнейшей обработке и акустооптическим фильтром

Вспомогательная оптическая система из зеркал, диафрагмы и поляризатора формирует изображение на входе акустооптического фильтра

Акустооптический фильтр, система переноса дифрагировавшего изображения и высокочувствительная охлаждаемая ПЗС-камера осуществляют обработку и детектирование гиперспектральных изображений
Акустооптический фильтр является ключевым звеном данной системы и позволяет осуществлять обработку изображений в двух принципиально различных режимах:
Для повышения чувствительности в качестве детекторов используются черно-белые охлаждаемые ПЗС-камеры с низким уровнем шумов, а длина волны сохраненного изображения, то есть его цвет, определяются настройкой акустооптического фильтра. При постобработке из гиперспектрального массива изображений может быть восстановлено цветное изображение или использована цветовая схема false color для повышения визуальной контрастности деталей.

Управление параметрами акустооптического фильтра осуществляется при помощи цифрового высокочастотного генератора

Фрагмент окрашенного гистологического среза фолликулярной аденомы человека. Увеличение объектива 40х. Слева: цветное изображение; в центре: гиперспектральное изображение, полученное при помощи акустооптической системы; справа: оконтуренное изображение, полученное при помощи акустооптической системы с лазерным освещением.

Флуоресцентные исследования образцов опухолевых тканей осуществляются при помощи лазерной системы эпифлуоресцентного освещения. На оптическом столе расположены два лазера: зеленый Nd:YAG-лазер с удвоением частоты на длину волны 532 нм и голубой Ar-лазер на длину волны 488 нм.

Излучение лазера через коллиматор заводится в поляризационно-сохраняющее одномодовое оптоволокно (слева), которое присоединяется к заднему порту микроскопа через специальный адаптер (справа)

В микроскопе для направления лазерного излучения на объект и фильтрации сигнала флуоресценции используются специальные светоделительные кубики с высококонтрастными светофильтрами (дихроичное зеркало + заграждающий фильтр) Semrock

Лазерное освещение попадает на объект – предметное стекло с нанесенным на него препаратом ткани – через тот же объектив, который и строит изображение на детекторе

Объектами исследований являются как окрашенные, так и неокрашенные гистологические срезы удаленных опухолей щитовидной железы человека

Исследуются различные случаи: доброкачественные, злокачественные и опухоли неопределенного злокачественного потенциала. Также производится сравнение с референтными образцами нормальной ткани
Сравнение изображений, полученных различными методами: обычное цветное изображение, гиперспектральные черно-белые изображения, флуоресцентное изображение,– позволяет подробно исследовать особенности различных тканей и получить дополнительную информацию об их строении. Исследование спектров флуоресценции позволяет наблюдать некоторые особенности тканей, не определяемые при обычной световой микроскопии.
Читайте также:

