Широкое распространение маммографии приводит к гипердиагностике рака молочной железы
Наиболее часто обсуждаемая врачами разных специальностей (гинекологами, онкологами, семейными врачами, радиологами, маммологами) тема — раннее выявление рака молочной железы. До сих пор большинство профессиональных медицинских обществ рекомендует проведение ежегодных маммографий у женщин 40–50 лет (конкретный возраст зависит от страны). Однако появилось немало данных о том, что такой вид скрининга дает немало ложноположительных результатов, что приводит к необоснованному оперативному вмешательству. Все чаще врачи и пациенты говорят о гипердиагностике (или сверхдиагностике), за которой фактически скрывается врачебная или госпитальная ошибка. Но так ли это?
Споры о необходимости и эффективности скрининга
Основная цель любого скрининга — своевременное выявление предраковых состояний и злокачественных образований на ранних стадиях, когда есть выбор в методах лечения и терапия в большинстве случаев успешна. Но говоря о разных видах онкологических заболеваний, которые мы условно называем раком (к сведению читателей, собственно рак — это вид злокачественных образований из эпителиальной ткани), важно понимать, что есть быстро прогрессирующие и медленно прогрессирующие формы рака. Скрининг рассчитан как раз на медленно прогрессирующие новообразования, потому что в большинстве случаев быстро растущий рак выявляется случайно, уже при наличии определенной клиники, то есть жалоб и симптомов, которые вынудили человека обратиться к врачу.
Однако судить об эффективности скрининга можно только при сравнении двух групп людей: тех, у которых проводился скрининг, и тех, кто скрининг не проходил. Причем наблюдение за этими контрольными группами должно быть длительным — в течение 30–40 лет. Проведение столь продолжительного клинического исследования с вовлечением большого количества участников не может позволить себе ни один исследователь, ни одно лечебное учреждение.
В отношении маммографии нет достоверных данных, подтверждающих наличие случаев, когда бы маммография оказалась лишней, хотя ложноположительные результаты есть, как и при любом методе обследования. Маммография имеет свои рамки применения, обусловленные уровнем чувствительности аппаратуры. Но если с помощью данного метода все-таки были обнаружены какие-то изменения в груди, имеет смысл выбрать правильную тактику дальнейшего обследования для постановки точного диагноза и последующего оптимального лечения.
Жаркие споры вызывает и вопрос возраста, с которого необходимо начинать скрининг на рак груди. В каждой стране могут быть свои рекомендации, но даже в одной стране рекомендации профессионалов могут значительно отличаться. Например, в США Американский колледж радиологов рекомендует проведение регулярных маммографий с 40 лет, Американское общество рака — с 45 лет, а Государственная организация по профилактике заболеваний (The US Preventive Services Task Force) — с 50 лет.
Данные большинства клинических исследований по раннему выявлению рака молочной железы основаны на наблюдении и обследованиях женщин от 40 лет и старше. Результаты исследований доказывают, что чем раньше у женщины выявлен рак, тем у нее больше шансов сохранить здоровье и продлить жизнь. Нередко реализацию скрининговых программ берет на себя государство, поэтому чаще всего они бесплатны для женщин, которые проходят профилактический осмотр. Но маммография не относится к дешевым методам обследования — она требует специального оснащения кабинетов и особой подготовки медперсонала. Далеко не все страны могут позволить себе бесплатные государственные скрининговые программы, которые бы охватывали огромные группы населения.
Таким образом, рекомендации в отношении возраста, с которого обязателен скрининг на рак груди, будут в большей степени отражать финансовый аспект проведения скрининга, скрытый от врачей и обычных людей, но основанный на рациональном подходе: какое количество женщин может пройти обследование бесплатно в данной стране в течение одного года (с учетом средней продолжительности жизни женщин).
Многие врачи рекомендуют изменить периодичность прохождения маммографии: с 40 до 50 лет женщинам желателен ежегодный скрининг, но с 50 лет он может проводиться уже раз в два года. Однако четких единых рекомендаций по этому вопросу пока нет.
Хотя все женщины после 40 лет должны проходить скрининг ежегодно, но сколько из них действительно это делают регулярно —- из года в год? Оказывается, всего 5–12 %, и это в развитых странах. К тому же достоверных данных, которые бы позволили сравнить, сколько женщин выживает после лечения среди тех, кто проходил скрининг регулярно, кто это делал периодически и кто не проходил его вообще, не существует. Объясняется это тем, что большинство женщин, причем даже в развитых странах, где подобные скрининговые программы бесплатны, не делают маммографию никогда, хотя статистика подтверждает, что чаще всего поздние стадии рака диагностируются у пациенток, не проходивших ранее маммографическое обследование. К сожалению, большинство женщин пока еще не понимают значение раннего выявления рака для их здоровья и жизни.
Причины гипердиагностики при маммографии
Трудности в определении уровня гипердиагностики часто связаны с классификацией разных видов рака молочной железы — нигде четко не оговорено, какой рак врачи должны считать инвазивным и какие виды дополнительной диагностики предлагать женщинам.
На сегодняшний день самое крупное исследование по определению эффективности маммографии было проведено в Дании. В течение 17 лет почти 20 % всего женского населения этой страны в возрасте 50–69 лет проходило маммографию. Ученых интересовали и опухоли меньше 20 мм, что считалось непрогрессирующим раком, и опухоли больше 20 мм, что оценивалось как рак поздних стадий, или прогрессирующий рак. Выяснилось, что диагностика непрогрессирующего рака значительно улучшилась, тем не менее уровень гипердиагностики составил 24 % для всех видов рака молочной железы и более 14 % — для его поздних стадий.
Наиболее печальный и спорный аспект тотального скрининга состоит в том, что в большинстве стран мира большинство женщин не смогут позволить себе качественное лечение обнаруженного у них рака молочной железы. Возникает моральная дилемма: зачем предлагать всем женщинам скрининг, если они не смогут пройти лечение? Например, в результате бесплатного скрининга на рак шейки матки у многих женщин из развивающихся стран был выявлен и диагностирован рак, но в бесплатном лечении пациенткам было отказано. Поэтому множество врачей считает, что крупномасштабные скрининговые программы себя не оправдывают, поскольку они не меняют качество жизни большинства женщин, даже если рак был выявлен вовремя и прогноз лечения благоприятный.
Широкое распространение маммографии приводит к гипердиагностике рака молочной железы. Результаты исследования опубликованы в Annals of Internal Medicine.
Когортное исследование датских ученых показало, что скрининговые программы, включающие маммографию, не снижают процент выявляемости пациенток с поздними стадиями рака молочной железы (РМЖ). При этом повышается частота обнаружения небольших медленно растущих опухолей, которые маловероятно будут представлять серьезную опасность для здоровья.
В рамках работы оценивались тенденции обнаружения опухолей размером более 20 мм (поздние стадии РМЖ) и менее 20 мм (ранние стадии РМЖ) у женщин, прошедших рутинный скрининг на рак молочной железы в 1980-2010 годах.
Проанализировав собранные данные, ученые заключили, что программы скрининга не снижают частоту выявления опухолей на поздней стадии развития. При этом на 14,7% и 24,4% повышают вероятность гипердиагностики инвазивных опухолей молочной железы и протоковой карциномы in situ (среди пациенток в возрасте 50-84 лет) соответственно. Среди женщин более молодого возраста риск гипердиагностики данных заболеваний достиг 48,3% и 38,6% соответственно.
Ранее канадские ученые пришли к выводу, что регулярные маммографические обследования женщин в возрасте 40-59 лет не влияют на показатели смертности от РМЖ. В ходе работы были изучены медицинские данные 89835 женщин, из которых 44925 регулярно проходили маммографию (каждый год в течение пяти лет), оставшиеся 44910 человек вошли в контрольную группу. Авторы работы отметили, что кумулятивная смертность от рака молочной железы в обеих группах находилась примерно на одном уровне, таким образом, регулярная маммография не привела к снижению смертности среди пациенток. Более того, в 22% случаях опухоли были диагностированы ошибочно.
Первоисточник:
Breast Cancer Screening in Denmark: A Cohort Study of Tumor Size and Overdiagnosis // Annals of Internal Medicine, 2017; DOI: 10.7326/M16-0270
Широкое распространение маммографии приводит к гипердиагностике РМЖ
- быстро находите необходимую информацию
- регулярные обновления по специальности
- полезные сервисы для ежедневной практики
- доступ к всемирно известным медицинским изданиям
- и многое другое только на Univadis
Univadis ® — международный информационно-образовательный портал, помогающий врачам всего мира оставаться на передовом рубеже в своих специальностях.
Univadis ® предоставляет беспристрастную медицинскую информацию, новости и образовательные ресурсы от ведущих мировых издательств.
Информация, размещенная на веб-сайте univadis.ru, предназначена только для специалистов здравоохранения, практикующих на территории РФ. MSD не несет ответственности за точность, содержание, методы или стандарты любых других источников, не принадлежащих компании MSD. Пожалуйста, ознакомьтесь с Условиями использования для получения дополнительной информации.
Проблема гипердиагностики в онкологии не нова. Еще в 30—40-е гг. XX в. патологоанатомы обращали внимание на существование так называемых латентных опухолей щитовидной и предстательной желез, которые обнаруживались при вскрытии больных, умерших не от онкологического заболевания. Сейчас эта проблема приобрела новое значение в связи с развитием высокочувствительных диагностических технологий, с помощью которых стало возможным выявлять такие образования уже при жизни человека
Гипердиагностика и последующее чрезмерное или вовсе ненужное лечение и связанные с ним риски – наиболее опасное последствие внедрения массового обследования населения или так называемой диспансеризации, которая набирает обороты в России. В западных странах программы скрининга для раннего выявления рака критически пересматривают и от некоторых из них просто отказываются.
Заболеваемость, выживаемость и смертность
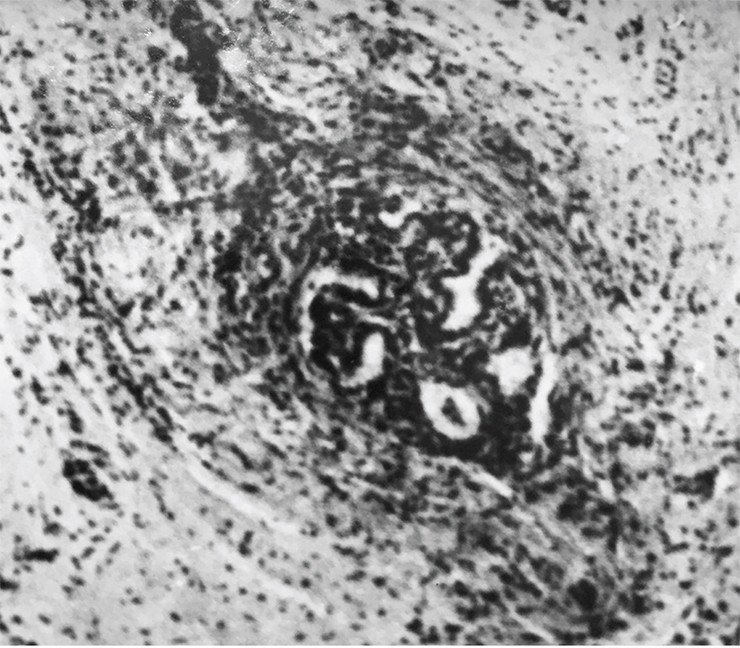
Папиллярная микрокарцинома щитовидной железы давно привлекла внимание патологов и клиницистов. Длительное наблюдение пациентов с диагнозом папиллярной микрокарциномы показало, что их продолжительность жизни не отличается от ожидаемой продолжительности жизни практически здоровых людей того же пола и возраста (Заридзе, 1973).
На основе данных, полученных при вскрытиях, можно предсказать частоту латентных раков в популяции и сравнить этот показатель с риском смерти от злокачественной опухоли того или иного органа. Латентный рак предстательной железы встречается очень часто: по данным разных авторов, он обнаруживается в 30—70 % случаев вскрытий мужчин старше 60 лет, умерших от неонкологических болезней (Breslow et al., 1977; Stamatiou et al., 2006). При этом популяционный риск умереть от рака простаты у мужчин в возрасте за шестьдесят всего 4 %.
Латентные раки щитовидной железы встречаются на вскрытии еще чаще, в 35—90 % случаев, а риск смерти от этой формы рака – всего 0,1 %. Клинически незначимый рак молочной железы может быть случайной находкой в 10—39 % случаев (Welch, Black, 2010), но риск смерти от этого заболевания не превышает 4 %. Таким образом, вероятность гипердиагностики этих заболеваний велика и по подсчетам составляет для рака простаты – около 90 %, рака щитовидной железы – 99 %, и рака молочной железы – 41—90 % (Harach et al., 1985; Welch, Black, 2010).
Судить о факте гипердиагностики крайне трудно в случае конкретного человека, но относительно легко – на уровне популяции: для этого надо сравнить статистические данные заболеваемости и смертности. Быстрый рост заболеваемости (или, точнее, выявляемости) той или иной формы рака в результате внедрения новых высокочувствительных методов диагностики при стабильной или уменьшающейся смертности указывает на возможность гипердиагностики. Например, в США рост заболеваемости раком щитовидной железы, почки, предстательной железы, молочной железы и меланомой кожи не только не сопровождался ростом смертности, но смертность от некоторых перечисленных форм рака даже снизилась (Welch, Black, 2010).
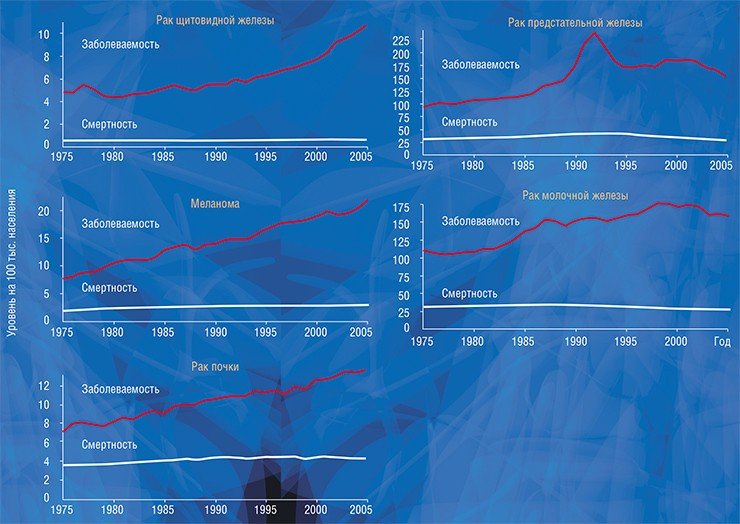
Американские авторы объясняют рост заболеваемости раком молочной железы гипердиагностикой, вызванной широким распространением маммографического скрининга, а предстательной железы – тестированием на простатический специфический антиген (ПСА). Анализ на ПСА, белковый маркер патологии предстательной железы, а не только рака, с 2014 г. не рекомендован к использованию в скрининговых программах из-за низкой специфичности и в результате гипердиагностики (Ibid). В то же время некоторое снижение смертности oт этих форм рака, по мнению тех же авторов, обусловлено не только прогрессом в лечении, но и ранней диагностикой клинически значимых опухолей.
Внутрипротоковый рак молочной железы in situ, до того как в 1980 г. получил распространение маммографический скрининг, встречался очень редко, составляя не более 2 % всех случаев рака молочной железы (Rosner et al., 1980). Но после внедрения скрининга выявляемость этой патологии резко выросла, составив к 2002 г. около 20 % случаев, диагностируемых на преинвазивной (ранней) стадии (Ernster et al., 2002), а применение магнитно-резонансной томографии увеличило эту цифру до 30 % (Kuhl et al., 2007).
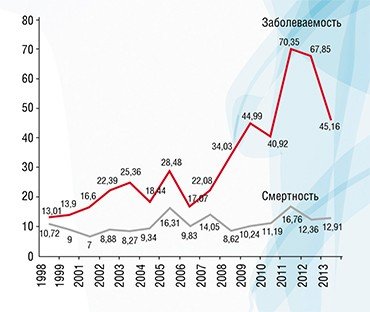
Рост заболеваемости раком щитовидной железы или, точнее, выявляемости клинически незначимых латентных образований – следствие широкого распространения ультразвукового исследования (УЗИ) органов шеи. Изучив динамику заболеваемости в развитых странах, исследователи из Международного агентства по изучению рака (МАИР) пришли к заключению, что в течение последних двух десятилетий количество случаев гипердиагностики рака щитовидной железы в двенадцати развитых странах достигло почти полумиллиона случаев: 470 тыс. мужчин и 9 тыс. женщин (Vaccarella at al., 2016). Рост заболеваемости раком почки тоже в большой степени объясняется распространением УЗИ – в этом случае органов брюшной полости. Так называемая онкологическая настороженность дерматологов и широкое применение диагностической процедуры дерматоскопии позволяет выявлять клинически незначимые меланомы кожи, динамика роста выявляемости которых в США отражает динамику роста частоты дерматоскопий.
В США выживаемость при раке молочной железы достигает 90 %, а при раке простаты – 100 %. Ожидаемая продолжительность жизни пациентов с папиллярной микрокарциномой щитовидной железы не отличается от ожидаемой продолжительности жизни людей того же пола и возраста. Эти очень высокие показатели выживаемости в значительной степени являются результатом гипердиагностики
И во всех этих случаях нет оснований говорить о том, что изменилось влияние известных факторов риска рака, за счет которых может расти заболеваемость, хотя нельзя полностью исключить истинный рост заболеваемости, например, раком почки за счет распространения в популяции таких факторов риска, как избыточный вес и недостаток физической активности.
В России и в Америке – одна картина
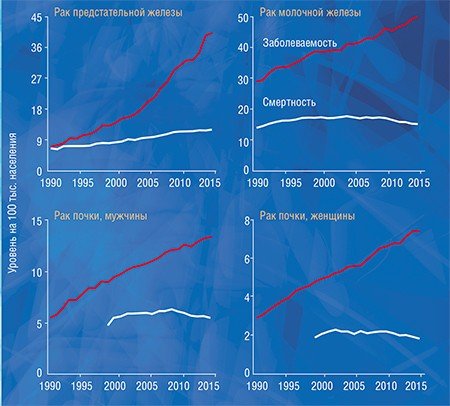
Чтобы понять, как влияет гипердиагностика на уровень заболеваемости раком в нашей стране, мы, используя данные статистики заболеваемости и смертности от рака, которые предоставили коллеги из МНИО им. П. А. Герцена, провели исследование, аналогичное американскому. Мы сравнили динамику заболеваемости меланомой, раком почки, предстательной, молочной и щитовидной желез с динамикой смертности от этих болезней и получили похожие результаты: резкий рост заболеваемости и незначительный рост смертности с дальнейшей стабилизацией или некоторым снижением.
Существует колоссальная разница между показателями заболеваемости раком предстательной и щитовидной железы в разных регионах России, а разница по смертности при этом далеко не так ярко выражена. Мы выяснили, что у пациентов с раком предстательной и щитовидной желез заболеваемость достоверно коррелирует с выживаемостью, т. е. в регионах с высокой заболеваемостью наблюдается высокая выживаемость. Это говорит о том, что заболеваемость растет за счет роста выявляемости клинически незначимых образований, а высокий показатель выживаемости указывает на то, что продолжительность жизни этих пациентов была бы такой же и без лечения.
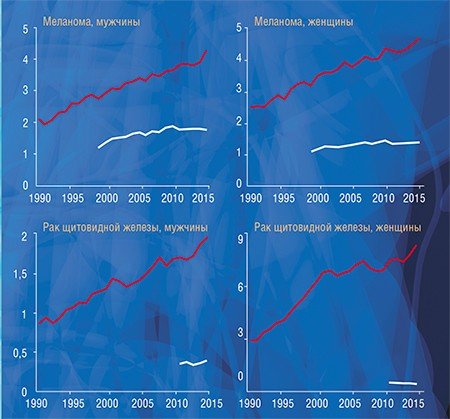
Как и в Америке, в России значительный рост заболеваемости раком за последние два десятилетия нельзя объяснить только ростом влияния известных или гипотетических факторов риска, а многократное увеличение разрыва между заболеваемостью и смертностью не может быть только следствием прогресса в лечении онкологических заболеваний. В эти годы и в нашей стране происходило широкое внедрение в практику высокочувствительных диагностических методов: ПСА, маммографии, УЗИ, компьютерной и магнитно-резонансной томографии, способных выявить латентные клинически незначимые новообразования.
Методом выбора ведения пациентов с бессимптомными, клинически незначимыми, латентными новообразованиями должен стать отказ от агрессивной терапии. Такая тактика позволит избежать ненужного, чрезмерного вмешательства, что, в свою очередь, предотвратит ухудшение качества жизни пациентов (сколько изуродовали мужчин на основании ПСА-тестирования!), а также приведет к сокращению расходов на лечение.
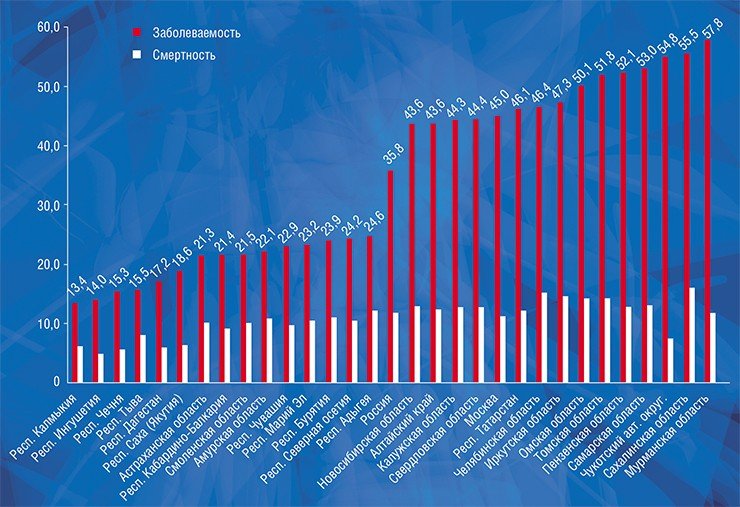
Показано, что в регионах, загрязненных радионуклидами в результате аварии на Чернобыльской АЭС, в рост заболеваемости раком щитовидной железы внес свой вклад скрининг УЗИ. До 40 % случаев рака щитовидной железы в этих регионах можно отнести к гипердиагностике (Ivanov et al., 2012)
К сожалению, у нас пока нет точных критериев, биомаркеров для определения прогноза, позволяющих отличить клинически незначимые образования от тех, которые прогрессируют. Необходимо проведение комплексных исследований, включая молекулярные, клинические, эпидемиологические. Крайне необходимо создание регистра пациентов с клинически незначимыми образованиями, с последующим длительным наблюдением за ними.
Такие исследования уже ведутся. Есть программа под названием Grand Challenge CRUK, которая финансируется британским онкологическим исследовательским фондом Cancer Research UK. Цель работы группы ученых из Великобритании, Нидерландов и США – выявить биологические маркеры прогрессии внутрипротокового рака молочной железы. Изучаются образцы тканей, взятые во время операции у женщин с этим диагнозом, собирается клиническая информация о пациентках, наблюдается развитие заболевания и дается его прогноз.
Пока нет четких критериев, нет ответа на вопрос, когда лечить необходимо, а когда нужно просто наблюдать. Но врачи должны знать об этой проблеме и одной из своих профессиональных задач ставить предотвращение практики чрезмерного агрессивного лечения, способного навредить пациенту.
Заридзе Д. Г., Пропп Р. М. О маленьком раке щитовидной железы // Архив патологии. 1973. Т. XXXV, № 12. С. 24—27
Breslow N., Chan C.W., Dhom G. et al. Latent carcinoma of prostate at autopsy in seven areas. The International Agency for Research on Cancer, Lyons, France // Int. J. Cancer. 1977. V. 15. N. 20. P. 680—688.
Ernster V. L., Ballard-Barbash R., Barlow W. E. et al. Detection of ductal carcinoma in situ in women undergoing screening mammography // J. Natl. Cancer. Inst. 2002. V. 16. P. 94. P. 1546—1554.
Ivanov V. K., Kashcheev V. V., Chekin S. Y. et al. Radiation-epidemiological studies of thyroid cancer incidence in Russia after the Chernobyl accident (estimation of radiation risks, 1991-2008 follow-up period) // Radiat Prot Dosimetry. 2012. V. 151. P. 489—499.
Kuhl C. K. Current status of breast MR imaging // Part. Clinical applications. Radiology. 2007. V. 244. N. 3. P. 672—691. Review.
Rosner D., Weiss L., Norman M. Ultrasonography in the diagnosis of breast disease // J. Surg. Oncol. 1980. V. 14. P. 83—96.
Stamatiou K., Alevizos A., Perimeni D. et al. Frequency of impalpable prostate adenocarcinoma and precancerous conditions in Greek male population: an autopsy study // Prostate Cancer Prostatic Dis. 2006. V. 9. P. 45—49.
Vaccarella S., Franceschi S., Bray F. et al. Worldwide Thyroid-Cancer Epidemic? The Increasing Impact of Overdiagnosis // N. Engl. J. Med. 2016. V. 18.N. 375. P. 614—617.
Welch H. G., Black W. C. Overdiagnosis in cancer // J. Natl. Cancer Inst. 2010. V. 102. N. 5. P. 605—613.
Читайте также:

