Рентгенологические симптомы характерные для рака пищевода

Ежегодно в мире регистрируется восемь миллионов новых случаев злокачественных опухолей и более пяти миллионов человек, умерших от них. Рак пищевода (РП) относится к наиболее злокачественным новообразованиям и входит в пятерку самых частых причин смерти среди онкологических пациентов. На протяжении 2003-2013 гг. абсолютное число выявленных случаев рака пищевода в Российской Федерации в среднем составило около 7500 ежегодно. Заболеваемость колеблется от 4,96 до 5,2 на 100 000 человек. Согласно мировой статистике мужчины болеют чаще женщин (М:Ж 7:1), пик заболеваемости приходится на период 50-60 лет [22]. Летальность больных в течение года с момента установления диагноза рака пищевода является самой высокой в структуре онкологической патологии и составляет 59,4 % [14]. Высокая злокачественность обуславливает низкую пятилетнюю выживаемость (5-20 %), что связано с поздним появлением первых клинических признаков, манифестирующих на поздних стадиях [3]. В среднем 70 % пациентов умирают от рака пищевода в первый год после постановки диагноза [5]. Основной задачей диагностики опухолей пищевода является оценка распространённости патологического процесса с целью стадирования и определения наиболее оптимального вида лечебной помощи. Современное развитие хирургии, химиотерапии и лучевой терапии позволяют значимо улучшить результаты лечения больных раком пищевода.
Для прогнозирования и последующей терапии большое значение имеет выявление распространения первичной опухоли (стадирование опухоли по T-критерию). Это направлено на определение резектабельности на основе точной оценки глубины опухолевой инфильтрации и инвазии в окружающие структуры [20, 38]. Для выбора адекватного способа лечения необходимо иметь информацию по TNM стадированию опухолевого процесса. T1 и T2 стадии отражают опухолевый процесс в пределах адвентиции. Точная дифференцировка между начальными стадиями важна для определения возможности подслизистой резекции - как варианта минимально инвазивного радикального лечения опухоли. Кроме того, дифференцирование между T1 и T2 имеет значение в принятии решения о проведении неоадьювантной терапии до операции [15]. Стадии T4a и T4b отражают инвазию в резектабельные и нерезектабельные смежные структуры, подразумевая то, что дифференциация между этими стадиями особенно важна для принятия решения о выполнении оперативного вмешательства или отказе от него. Наиболее важным прогностическим фактором в лечении резектабельной формы рака пищевода является выявление поражения лимфатических узлов [27]. Точная предоперационная оценка степени поражения регионарных лимфатических узлов имеет решающее значение, как для хирургического лечения, так и для и планирования лучевой терапии. Таким образом, точная диагностическая оценка стадирования опухолевого процесса при раке пищевода необходима для планирования вида и объема терапии. Новые методы лечения ставят перед собой ряд диагностических вопросов. В отечественных и ведущих зарубежных клинических рекомендациях, посвященных диагностике и лечению злокачественных опухолей пищевода, ведущую роль придают следующим методикам: эндоскопическое исследование пищевода и желудка с биопсией, рентгенологическое исследование легких, пищевода и желудка, компьютерная томография брюшной и грудной полостей, эндосонография, позитронно-эмиссионная томография с фтородеоксиглюкозой, или Ф18-ФДГ (как правило, при запущенных формах).
1. Рентгенологический метод
Рентгеноскопия с применением контрастных веществ на основе сульфата бария до развития рентгеновской компьютерной томографии и эндосонографии являлась наиболее распространенным и доступным методом диагностики рака пищевода [6, 7, 12]. Рентгенологическая картина при опухолевом процессе большей протяженности позволяла установить наличие заболевания. Однако недостаточная выраженность рентгенологических признаков на ранних стадиях патологического процесса затрудняет диагностику. Наиболее частыми рентгенологическими признаками экзофитного рака пищевода на ранних стадиях являются краеобразующий или на рельефе дефект наполнения, разрушение рельефа слизистой и ригидность стенок пищевода [1, 7, 12]. Ранние формы эндофитного рака пищевода представлены двумя формами: язвенно-инфильтративная форма и инфильтративно-стенозирующая. На более поздних стадиях опухоль циркулярно охватывает пищевод, где на уровне изменений рентгенологически определяется характерное сужение, верхние границы которого имеют бугристые контуры, соответствующие краям инфильтративного роста. Выше опухолевого процесса, в ряде случаев определяется супрастенотическое расширение различной степени выраженности, в зависимости от степени и времени существования стенозирующего процесса, при этом нижняя граница опухоли определяется недостаточно точно [11]. Вышеуказанные рентгенологические признаки, характерные для рака пищевода, определяют изменения внутренней поверхности просвета пищевода и позволяют определить локализацию, протяженность, форму роста, наличие осложнений, в частности,- формирование свищей [5, 26, 30]. Несмотря на возможности рентгенологической визуализации, истинная распространенность неопластического процесса и отношение опухоли к окружающим органам и тканям остается вне поля зрения [8].
Для визуализации распространения опухолевого процесса в стенке пищевода использовался метод рентгеновской париетографии, основанный на принципе двойного негативного контрастирования. Наряду с эффективностью в оценке локализации опухоли, метод отличался высокой инвазивностью, сложностью исполнения и наличием осложнений, связанных с повреждением крупных сосудов, перикарда, плевры [11]. Для определения степени инвазии рака пищевода в окружающие ткани рядом авторов было предложено использовать азигографию в различных вариантах: с введением контрастного препарата в губчатую ткань ребер, а также чрезкожно с проведением катетера до непарной вены [4, 42]. В настоящее время для диагностики опухолей пищевода используется рентгеноскопия с пероральным контрастированием взвесями, содержащими сульфат бария, и водорастворимыми средствами на основе препаратов йода [4].
2. Рентгеновская компьютерная томография
В 1979 Daffer на примере 23 пациентов впервые показал, что использование рентгеновской компьютерной томографии (РКТ) в диагностике распространения рака пищевода вполне оправдано: по данным операционного материала из 23 больных у 21 пациента (91 %) была точно установлена распространенность опухолевого процесса. В последующие годы многие авторы уделяли внимание определению степени распространенности рака пищевода [2, 10, 24]. По мере накопления материала были опубликованы разноречивые данные относительно применения РКТ. Так, в 1981 г. Моss А. показал высокую диагностическую ценность РКТ по сравнению с другими методами диагностики: применение РКТ позволило выявить у 95 % больных изменения в предлежащих к опухоли структурах [29]. В свою очередь Coulomb М. и Grimm Н. отмечали, что данные операционного материала соответствовали данным РКТ всего в 40-53 % случаев [19]. В ряде работ отмечается, что на ранних стадиях РКТ не позволяла отчетливо локализовать опухолевый процесс [34, 36]. С другой стороны, Рындин В. Д. и соавторы на основании данных обследования 60 больных раком пищевода утверждали, что РКТ, несмотря на относительно высокую частоту совпадения результатов с операционным материалом, не может в полной степени быть ведущим методом в определении резектабельности. Была отмечена высокая точность метода у пациентов с неинвазивными формами рака (94 %). При инвазии в окружающую жировую клетчатку точность диагностики снижалась до 66 % [9, 39]. Приведенные данные вызваны относительно невысокой тканевой чувствительностью метода РКТ, при которой оценка критериев распространенности в определенных ситуациях является субъективной. Так, многие авторы отмечают, что визуализация четких контуров стенки пищевода, наличия неизмененной параэзофагельной клетчатки дает право предполагать ограниченность опухолевого процесса пределами органа. А наличие нечеткости внешних контуров стенки, тяжистости и уплотнения параэзофагеальной клетчатки, или полное её исчезновение, указывают на распространение неопластического процесса за пределы органа. При этом те же авторы отмечают, что затруднительно проводить анализ признаков инвазии по результатам РКТ у больных с плохо развитой клетчаткой средостения, как это часто бывает у истощенных раком пищевода пациентов [34]. Аналогичная противоречивая картина характерна для работ, посвященных оценке опухолевой инвазии в трахею, бронхи и аорту. Точность метода РКТ в определении трахеобронхиальной инвазии по данным авторов колеблется от 74 до 97 %, а точность метода в определении вовлечения в опухолевый процесс аорты составляет от 58 до 94 % [13].
Применение РКТ в оценке распространенности процесса поражения лимфатических узлов имеет ограниченное значение (чувствительность 50 %, специфичность 83 %) [28, 16]. Планирование лучевой терапии, как правило, основывается на данных РКТ и результатах эндоскопического исследования. Однако, исходя из данных многих авторов, РКТ достоверно не отражает гистопатологическую степень распространения опухоли.
Для диагностики патологии пищевода в настоящее время используются эндосонографические датчики с частотой 7,5-20,0 МГц, которые позволяют визуализировать слои стенки пищевода с высокой степенью гистологической корреляции [18, 23, 25]. Опираясь на систему TNM стадирования, в 1988 г. Sobin L. с соавторами на основе метода эндосонографии предложили классификацию глубины опухолевой инвазии при раке пищевода: 1.EUS-T1 - опухолевое поражение слизистого и подслизистого слоя без вовлечения собственно мышечного слоя; 2. EUS-T2 - опухолевое поражение мышечного слоя; 3. EUS-T3 - распространение опухоли до серозной оболочки; 4. EUS-T4 - выход опухолевого процесса за пределы серозной оболочки. В настоящее время эндоскопическое ультразвуковое исследование (ЭУЗИ) является методом выбора для определения местного распространения опухоли. Согласно исследованиям, посвященным диагностической ценности ЭУЗИ, для T-стадирования рака пищевода точность метода высока и составляет 82-92 % [33]. Однако ЭУЗИ является потенциально инвазивной техникой, коэффициент отказа при которой составляет 14-25 %. Причина - стенозирующие формы опухоли, которые затрудняют прохождение эндоскопа. Кроме этого, диагностическая ценность ЭУЗИ в значительной степени зависит от опыта врача-эндоскописта. Бесспорным преимуществом ЭУЗИ является возможность забора материала для цитологического исследования. По мнению Eloubeidi M.A. и соавторов, использование ЭУЗИ в сочетании с биопсией резко повышает диагностическую точность метода [21]. По данным Van Vliet E.P. чувствительность ЭУЗИ с биопсией составляет 80 %, специфичность 70 % [40]. По мнению некоторых исследователей, ЭУЗИ имеет ограниченное значение в дифференцировке остаточных опухолевых масс и фиброзно-воспалительных изменений. Эти ограничения подтверждают, что ЭУЗИ после химиолучевой терапии имеет низкую точность в оценке лечебных изменений (от 27 до 82 %) [41, 43].
4. Позитронно-эмиссионная томография
Большинство исследователей считают, что позитронно-эмиссионная томография, совмещенная с КТ (ПЭТ-КТ) не может успешно оценить местное распространение опухоли по причине ограниченного пространственного разрешения в сравнении с ЭУЗИ и РКТ [43]. По данным ряда авторов, метод ПЭТ обладает весьма ограниченными возможностями в оценке региональных лимфатических узлов: чувствительность метода 51 %, специфичность 84 %. В литературе нет достоверных данных об успешном и эффективном применении ПЭТ в планировании лучевой терапии [41]. Применение ПЭТ в оценке неадьювантной химиотерапии у больных раком пищевода имеет низкую точность: 15-21 % [43].
Рентгенологическое исследование пищевода является очень важным для полноценной оценки анатомо-физиологических особенностей заболевания.
С помощью рентгенологических методов исследования изучают топографию и анатомию пищевода. По движению контрастного вещества оценивают пропульсивную способность, отмечают дискинетические изменения, гастроэзофагеальный рефлюкс, наличие стриктур, язв и опухолей (рис. 58). Рентгенологическое исследование выполняют на трохоскопе в положении больного стоя и лежа.

Рис. 58. Открытие нижнего сфинктера пищевода при глотании (А и В)
и в положении лежа (С).
Рентгенологический метод дает возможность оценить состояние соседних органов и систем: кровообращения, дыхания, а также средостения, которые также могут быть источником болей в грудной клетке. Органы, которые необходимо исследовать для полной картины распространенности процесса: пищевод, желудок и легкие (обязательно с томографическим исследованием средостения на уровне корней легких).
Существуют три рентгенологические методики исследования пищевода: 1) тугое заполнение просвета органа контрастным веществом; 2) двойное контрастирование (рис. 59); 3) изучение рельефа слизистой оболочки пищевода.
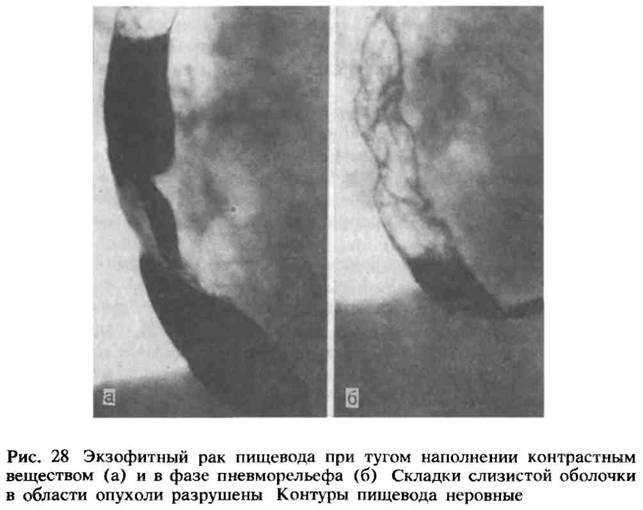
Рис. 59. Экзофитный рак пищевода при тугом наполнении контрастным веществом и в фазе пневморельефа. Складки слизистой оболочки в области опухоли разрушены, контуры пищевода неровные.
Сейчас предпочитают методику двойного контрастирования, когда на фоне воздуха в просвете пищевода с обволакиваем контрастным веществом внутренних поверхностей его стенок, что позволяет отчетливо определять патологические изменения.
Задачи рентгенологического исследования:
1) определение локализации первичной опухоли по сегментам пищевода;
2) оценка протяженности поражения, степени вовлечения в опухолевый процесс стенок пищевода (циркулярное поражение или частичное);
3) определение наличия изъязвлений, их формы, размеров, глубины, характеристика окружающего изъязвление вала;
4) выявление и оценка выраженности сужения просвета;
5) анализ изменений рельефа слизистой оболочки, характеристика контуров (ровные или неровные, четкие или нечеткие);
6) выявление степени эластичности стенок;
7) определение степени и выраженности экзофитного и эндофитного компонентов опухоли (экзофитная, эндофитная, смешанная с изъязвлением или без такового);
8) определение положения пищеводной оси, оценка состояния пищеводной стенки (ее целостность, угроза перфорации, образование пищеводно-медиастинальных, пищеводно-трахеальных, пищеводно-бронхиальных свищей) (рис. 60).
 | Рис. 60. Рентгенологическое исследование.Бронхопищеводный свищ, выявленный при введении в пищевод водорастворимого контраста. |
9) определение состояния пищевода проксимальнее и дистальнее участка поражения, сопутствующее супрастенотическое расширение, эзофагит, отсевы основной опухоли в другие участки пищевода;
10) выявление возможного распространения опухоли на соседние органы;
11) выявление косвенных признаков увеличения регионарных лимфатических узлов;
12) выявление сопутствующих заболеваний пищевода (дивертикулов, грыжи пищеводного отверстия диафрагмы, рефлюкс-эзофагита, ахалазии, эзофаго- и кардиоспазма).
Несмотря на все расширяющийся спектр диагностических возможностей и их информативность, каждый из них имеет свои показания и ограничения.
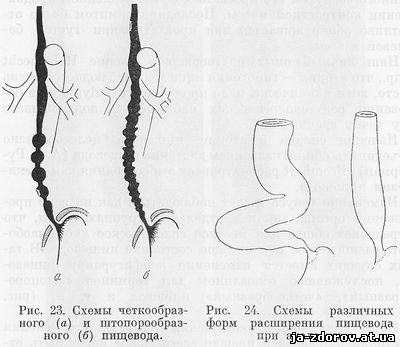
По клинико-рентгенологическим признакам можно выделить эндофитную, или инфильтративную, экзофитную, или полипозную, и смешанную формы рака. Экзофитная опухоль может изъязвляться и приобретать форму смешанной блюдцеобразной карциномы.
Экзофитный (полипозный) рак растет преимущественно в просвет пищевода, образуя в нем при заполнении контрастом дефект наполнения с неправильными, полициклическими очертаниями. При циркулярном расположении экзофитной опухоли пищевод на определенном протяжении становится суженным, контуры сужения неровные, ригидные. Переход от суженного участка к нормальному контуру часто обрывистый, ступенчатый. В зоне опухоли складки слизистой оболочки разрушены, внутренняя поверхность пищевода образована рельефом опухолевых масс в виде множественных узлов неправильной формы. Изъязвления поверхности опухоли образуют стойкие депо контрастного вещества с неровными контурами (рис. 61).


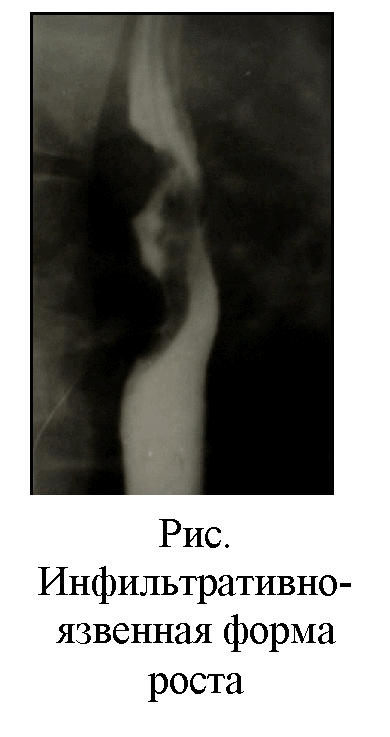
Рис. 61. Рентгенологическое исследование. Нарушение проходимости контрастной массы, дефект наполнения, неровные контуры.
Характерную картину имеет блюдцевидный рак (рис. 62). Для его выявления необходимо выбрать оптимальную проекцию при рентгеноскопии. Приподнятые в виде вала и хорошо отграниченные от окружающей интактной ткани края опухоли образуют кольцевидный или овальный дефект в просвете пищевода, окружающий язвенный кратер с неровными и неправильными границами, расположенный в центре. Если опухоль проецируется на контур пищевода, она образует два валообразных дефекта с язвенной нишей между ними. Контуры ниши неровные, конфигурация не меняется в процессе исследования. Продольные размеры изъязвления, как правило, преобладают над поперечными.


Рис. 62. Рентгенологическое исследование. Блюдцевидный рак.
Инфильтрирующий эндофитный рак в начальной стадии вызывает появление небольшого ригидного участка на контуре пищевода, который при прохождении перистальтической волны выглядит спрямленным. По мере роста опухоли становится заметнее сужение просвета пищевода, проявляется мелкая зазубренность, неправильность контуров и разрушение складок на месте роста опухоли. Пищевод выше новообразования расширяется.
Инфильтративный рак дистальной части пищевода может вызвать укорочение пищевода и смещение кардии в грудную полость. Сужение пищевода может достигать степени полной непроходимости. В этом случае следует после удаления бария повторить исследование с водорастворимым контрастом, это позволяет получить изображение узкого ракового канала и уточнить его протяженность.
Прорастание рака пищевода в соседние органы с распадом ведет к образованию пищеводно-трахеальных, пищеводно-бронхиальных и пищеводно-плевральных свищей.
В далеко зашедших стадиях рак пищевода осложняется образованием пищеводных свищей в результате прободения в различные органы. Наличие свища в средостение, сердце и аорту дает характерную клиническую картину (Н. Я. Кузнецовский). Перфорация в трахею, бронхи, легкие хотя и может быть заподозрена на основании клинических данных, однако должна быть подтверждена результатами рентгенологического исследования.
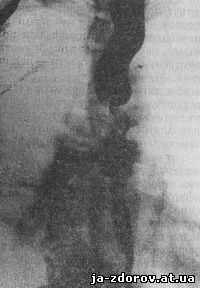
Рис. 14. Перфорация рака пищевода. Контрастная взвесь определяется в правом бронхиальном дереве.
Рентгенологическая картина существующего свища довольно типична (Х. 3. Гизатулин, А. А. Цейтлин, М. Е. Гиндес). Контрастная масса, пройдя по пищеводу до места расположения опухоли, в зависимости от степени сужения просвета задерживается, а затем проникает в нижележащий отдел пищевода. Одновременно от одной из стенок пищевода отделяется полоска бариевой взвеси, длина которой может быть очень небольшой, но иногда достигает и значительных размеров. Если свищ достаточно широк и в трахею или бронхи проникает много бариевой взвеси, можно наблюдать заполнение бронхиального дерева (рис. 14).
Необходимо подчеркнуть парадоксальный факт, что проникновение через свищ контрастной массы в трахею и бронхи не всегда сопровождается кашлем. Нередко можно наблюдать заполнение бронхов при спокойном состоянии больного и появление кашля только спустя некоторое время.
Иногда можно увидеть на рентгеновском экране момент перфорации пищевода, когда при прохождении взвеси бария от одной из изъязвленных стенок пищевода внезапно отделяется узкая полоска контрастной массы, заполняющая трахею или бронх. Обычно перфорация не сопровождается выраженными болевыми ощущениями.
Комки бария в трахее и бронхах не всегда являются результатом существования эзофаготрахеального или эзофагобронхиального свища.
Нередко параличи и парезы гортанного нерва сопровождаются большим или меньшим затеканием бариевой взвеси в воздухоносные пути, что может симулировать наличие фистулы.
Наличие опухолей и других патологических процессов в глотке и гортани также может нарушить нормальный глотательный акт и привести к тем же последствиям.
Следует подчеркнуть, что выявление свищевого хода чаще говорит о раковой его этиологии, однако нельзя забывать, что инородное тело пищевода, туберкулез, сифилис, пептическая язва и т. д. тоже могут, хотя и редко, вызвать перфорацию (С. Г. Гурылева, А. И. Фельдман, Б. Е. Линберг, В. Н. Зак и др.). Поэтому дифференциальная диагностика должна проводиться с учетом анамнеза, клиники и данных всех диагностических исследований.
В дифференциально-диагностическом плане рентгенологическая картина сужения пищевода заставляет думать о различной этиологии стеноза: доброкачественная или злокачественная опухоль или сдавление его извне.
Рентгенологические признаки доброкачественных опухолей, так же как и признаки рака, весьма сходны. Они могут быть обнаружены на любом уровне пищевода, однако чаще наблюдаются на протяжении дистального его отрезка.
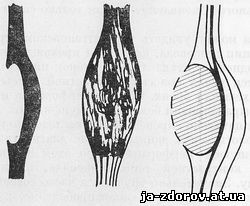
Рис. 15 Схемы проецирования внутристеночной доброкачественной опухоли пищевода.
К рентгенологическим признакам внутристеночной доброкачественной опухоли относится резко очерченный дефект наполнения: просвет пищевода на уровне опухоли оказывается иногда как бы смещенным в сторону, противоположную ее локализации; в других проекциях просвет расширен. При краевом расположении дефекта угол между опухолью и нормальной стенкой пищевода приближается к острому. Складки слизистой оболочки выявляются только на стенке, противолежащей опухоли (рис. 15). Соответственно дефекту наполнения на фоне средостения часто обнаруживается полуовальная тень.
При наличии дольчатой опухоли, если ее узлы располагаются на разных уровнях, контрастная взвесь, заполняющая ложбинки между отдельными выпячиваниями, создает картину перекреста контуров. Весьма важным признаком является изменяющаяся при перистальтических сокращениях конфигурация стенки пищевода в области расположения опухоли.
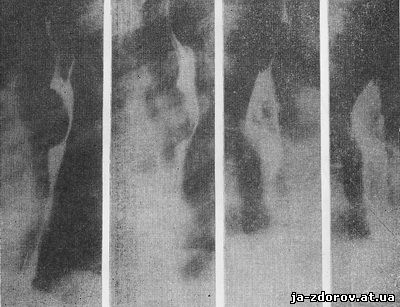
Рис. 16. Рентгенограммы пищевода. Внутристеночная доброкачественная опухоль (лейомиома).
Лучше всего из доброкачественных внутристеночных опухолей пищевода изучена рентгенологическая картина при лейомиоме (Е. М. Каган, А. И. Рудерман, Т. А. Суворова и др.). Однако диагноз и других внутристеночных опухолей: фибромы, липомы, невриномы и др., а также кисты стенки пищевода основывается на перечисленных рентгенологических признаках. Во всех случаях подозрения на доброкачественную внутристеночную опухоль или кисту пищевода совершенно обязательно сопоставление рентгенологических данных с эзофагоскопическими (рис. 16). При эндоскопии в таких случаях может обнаруживаться или неизмененная по виду слизистая оболочка, как бы растянутая над внутристеночно расположенной опухолью или кистой, или же явления ишемии, воспаления и относительно редко - изъязвления.
Сопоставление рентгенологических данных с результатами эндоскопической биопсии в большинстве случаев невозможно, поскольку последняя при неповрежденной слизистой оболочке противопоказана. Таким образом, рентгенологические данные, сопоставленные с результатами других методов исследования, лежат в основе диагноза доброкачественной внутристеночной опухоли.
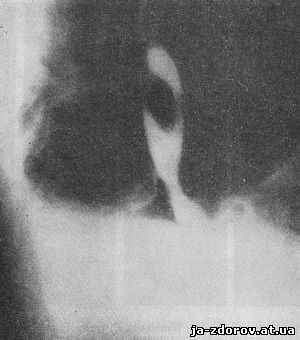
Рис. 17. Рентгенограмма пищевода. Полип.
Рентгенологические признаки внутрипросветной доброкачественной опухоли - полипа, т. е. образования, исходящего из слизистой оболочки и являющегося таким образом по отношению к пищеводу внутрипросветным, это разной величины единичные, реже множественные дефекты наполнения с четкими гладкими контурами, которые как бы обтекает контрастная масса (рис. 17). Смещаются они вместе со стенкой пищевода. Полипы могут изъязвляться; в более редких случаях они имеют ножку и могут забрасываться в глотку или проникать в желудок. Характерным является и то, что стенка пищевода перистальтирует и на участке расположения полипа.
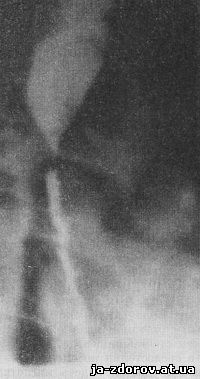
Рис. 18. Рентгенограмма пищевода. Рубцовый стеноз после химического ожога.
При обнаружении рентгенологических изменений в пищеводе, присущих доброкачественной опухоли или кисте, дифференциально-диагностическая задача сводится прежде всего не столько к уточнению характера опухоли, сколько к подтверждению или исключению наличия озлокачествления этого образования. Последнее устанавливается на основании подробно описанных выше рентгенологических признаков рака пищевода.
Рентгенологическая картина рубцового стеноза пищевода после бывшей химической или термической его травмы довольно характерна - наличие более или менее протяженного симметричного сужения пищевода с относительно ровным или волнистым контуром суженного участка (рис. 18). На длительное существование стеноза указывает наличие супрастенотического расширения с признаками сопутствующего эзофагита.
Дифференциальная диагностика не трудна, когда факт травмы пищевода в прошлом известен. Однако в тех редких случаях, когда при рубцовом стенозе контуры пищевода оказываются несимметрично зубчатыми и рентгенологическая картина весьма напоминает сужение на почве рака, возникают значительные диагностические трудности. Нельзя забывать и о возможности развития злокачественной опухоли в рубцово измененном участке пищевода.
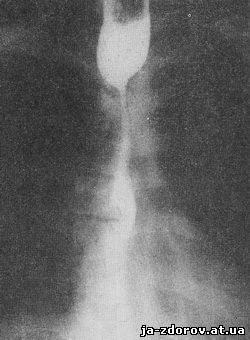
Рис. 19. Рентгенограмма пищевода при склерозирующем медиастините.
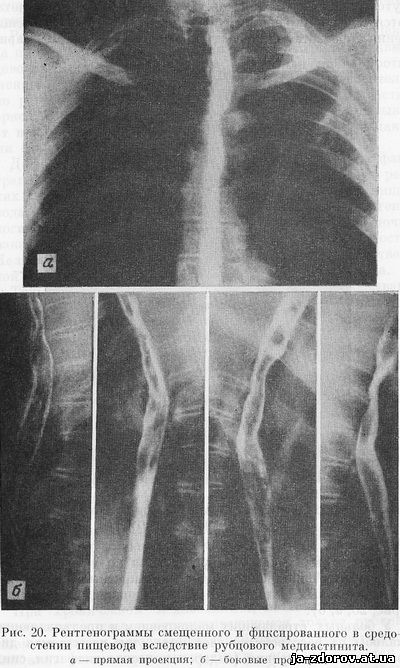
При хроническом медиастините, не заканчивающемся склерозированием, а ограничивающемся только рубцеванием клетчатки и медиастинальной плевры, конфигурация пищевода изменяется, смещаемость его уменьшается и подвижность резко ограничивается. Однако стенозирования пищевода не наступает и его проходимость при этом не нарушается, перистальтика стенок пищевода в подтянутом участке сохраняется. Если эти изменения сочетаются с деформирующим спондилозом, то во время расширения просвета пищевода проходящим комком бария на задней стенке его обнаруживаются полуовальной формы дефекты наполнения от давления краевых разрастаний замыкательных пластинок тел прилежащих позвонков (рис. 20, а, б).
У больных, страдающих малокровием и предъявляющих жалобы на расстройства глотания - так называемая дисфагия при малокровии (сидеропеническая дисфагия, синдромы Plummer - Vinson; Kelly - Paterson; Waldenstrom - Kjelberg), рентгенологическое исследование позволяет выявить интересные особенности - различной глубины втяжения или дефекты наполнения контуров стенок глотки и трахеального сегмента пищевода. Иногда это одиночные или множественные зазубрины либо перетяжки, лучше видимые на передней и задней стенках. По данным С. С. Даниленко, в части случаев наблюдаются вызванные перетяжками даже значительные сужения просвета пищевода на ограниченном участке - до 1 см в длину (рис. 21, а, б).
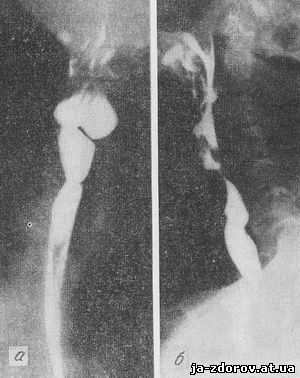
Рис 21. Рентгенограммы пищевода при дисфагии, связанной с малокровием.
а - прямая проекция; б - боковая проекция.
Дифференциальная диагностика основывается на наличии перистальтики; при сидеропенической дисфагии перистальтика полностью сохраняется. Однако высокий процент возникновения рака пищевода у подобных больных требует внимательного динамического клинико-рентгенологического наблюдения за течением болезни.
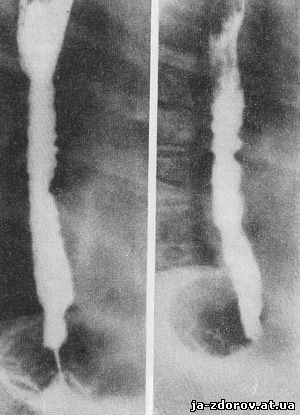
Рис. 22. Рентгенограммы пищевода при сегментарном спазме.
Сужение просвета пищевода в результате сегментарного спазма характеризуется повторяемостью рентгенологической картины. На каком-либо одном участке пищевода или на нескольких уровнях наблюдается появление одной или нескольких перетяжек (рис. 22), которые никогда не перемещаются по длиннику пищевода и могут быть видимыми короткие или длительные отрезки времени, однако они всегда исчезают в другие фазы исследования. Именно это указывает на их функциональный генез.
Нарушение нормального тонуса стенок пищевода может выражаться не только в тоническом напряжении - спазме, но и в расслаблении, т. е. атонии. Рентгенологические симптомы атонии пищевода проявляются в зиянии заполненного воздухом его просвета и более медленном продвижении контрастной массы. Последний симптом более отчетливо обнаруживается при проглатывании густой бариевой взвеси.
Наш личный опыт подтверждает мнение Holzknecht и др., что атония - гипотония пищевода наблюдается очень часто, хотя клинически мало проявляется. Palyguay на основании рентгенологических наблюдений поддерживает эту точку зрения.
Явления спазма и атонии пищевода целесообразно объединить общим названием дистонии пищевода (А. И. Рудерман); Brombart рассматривает эти состояния как дискинезии пищевода.
Наши клинические наблюдения показали, что явления дистонии пищевода и прежде всего спазм могут быть отраженным симптомом заболеваний других органов: глотки, желудка, двенадцатиперстной кишки, желчного пузыря, червеобразного отростка, половых органов, сердца, аорты и т. д. Самое тщательное и педантичное рентгенологическое и эзофагоскопическое исследование в таких случаях не выявляет каких-либо органических изменений пищевода.
Наряду с этим сегментарный спазм пищевода может сопутствовать различного рода травмам слизистой оболочки, ожогам или явлениям эзофагита. В то же время нельзя забывать, что сегментарный спазм может быть сопутствующим другим симптомам или даже первым рентгенологическим выражением органического поражения стенки пищевода раковой опухолью.
Рентгенологическая картина ахалазии пищевода зависит от фазы течения заболевания. В начальной, редко выявляемой, стадии обнаруживается перемежающееся неполное раскрытие кардии или спастические сокращения на протяжении 2 - 3 дистальных сегментов пищевода без стойкой задержки контрастной массы и значительного расширения просвета органа.
Поздние стадии ахалазии - кардиоспазма имеют характерную рентгенологическую картину: срединная тень расширена за счет значительного увеличения диаметра просвета пищевода, который иногда удлиняется и образует на протяжении нижней своей трети несколько изгибов (рис. 24). Контрастная взвесь медленно тонет в содержимом пищевода и обрисовывает постепенный переход расширенного пищевода в узкую симметричную воронку, заканчивающуюся в области кардиального жома. Форму дистального конца пищевода можно сравнить с острием веретена или кончиком сигары. Часто выявляется сопутствующий сегментный спазм, симулирующий живую перистальтику стенок воронки и редкую малоинтенсивную истинную перистальтику стенок вышележащих отделов пищевода, однако обычно не заканчивающуюся раскрытием кардии (А. 3. Моргенштерн). Периодически при увеличении содержимого пищевода и при повышении гидростатического внутрипищеводного давления наблюдается большее или меньшее раскрытие сокращенного участка и поступление жидкого содержимого в желудок. При этом нередко удается видеть грубые, неравномерно расширенные складки слизистой оболочки пищевода, являющиеся отображением сопутствующего эзофагита.
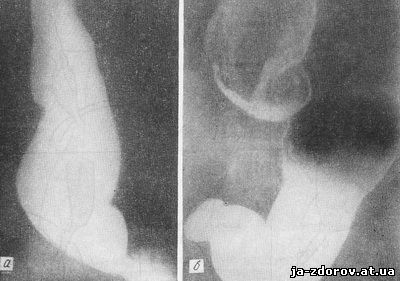
Рис. 25. Рентгенограммы пищевода и кардиального отдела желудка при ахалазии.
а - заполненный контрастной взвесью пищевод; воздуха в желудке нет; б - воздух в пищеводе и желудке после искусственного раздувания.
Рис. 26. Схемы изв пищевода.
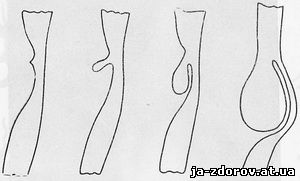
Рис. 27. Схема развития глоточно-пищеводного (ценкеровского) дивертикула.
Рентгенологическая картина дивертикула пищевода характеризуется выпячиванием стенки пищевода на ограниченном участке (рис. 27). Выпячивание может иметь полуовальную, мешкообразную, треугольную или остроконечную форму с вершиной, направленной кверху или книзу. Иногда дивертикул может иметь весьма причудливый вид и достигать больших размеров. Некоторые небольшие дивертикулы выявляются только в фазе значительного расширения просвета пищевода, другие - в фазе его опорожнения. Почти всегда стенки дивертикулов, не осложненных развитием злокачественной опухоли, имеют ровные очертания и отчетливо перистальтируют. Наличие или отсутствие перистальтики может служить до известной степени критерием отличия истинного дивертикула от ложного: при первом имеется выраженная перистальтика, тогда как при втором она отсутствует. Только при очень больших, длительно существующих истинных дивертикулах перистальтика может не выявляться. В больших и свисающих дивертикулах контрастная взвесь обычно длительно задерживается (рис. 28), при этом часто обнаруживаются рентгенологические признаки воспаления - дивертикулита - неровные, зубчатые контуры, утолщения, эрозированная слизистая оболочка. Выявление дивертикулита предполагает тщательное изучение обнаруженных изменений для исключения рака, нередко развивающегося в стенке дивертикула или рядом с ним (И. Л. Тагер). Нужно указать на часто игнорируемую возможность развития злокачественной опухоли в пищеводе, на стенке которого уже давно существовал дивертикул, однако без всякой связи с ним или на значительном отдалении от него.
Рис. 28. Рентгенограмма пищевода с дивертикулом в ретрокардиальном сегменте. Сопутствующий дивертикулит и склерозирующий эзофагит.
Варикозно расширенные вены выявляются при рентгенологическом исследовании в виде множества округлых и овальных с ровными контурами проекционно накладывающихся друг на друга просветлений. Последние создают как бы множество дефектов наполнения на слизистой оболочке и неровный зубчатый контур стенки пищевода (рис. 29). Рентгенологическая картина меняется с изменением положения больного: при горизонтальном положении она может исчезнуть, а при вертикальном - стать более отчетливой. Последнее имеет место также и при пробе Вальсальвы. Характерно для этого патологического состояния полное сохранение сократительной способности стенки пищевода - отчетливая перистальтика прослеживается на всем его протяжении.
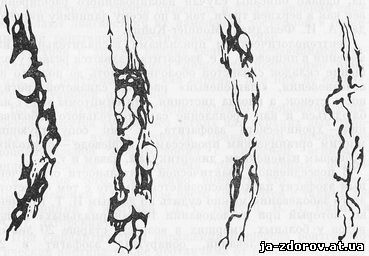
Рис. 29. Виды слизистой оболочки при варикозном расширении вен пищевода (схемы).
Расширение вен пищевода очень часто сочетается с расширением вен желудка (А. И. Мелик-Арутюнов), что также должно быть установлено целеустремленным рентгенологическим исследованием. Почти всегда расширенные вены локализуются на протяжении нижней трети пищевода, однако описаны случаи изолированного расширения вен как в верхней трети, так и по всему длиннику пищевода (А. И. Фельдман).
Патологоанатомически эзофагит выражается в застойных процессах в слизистой оболочке и подслизистом слое, гиперплазии покровного эпителия с явлениями пролиферации, иногда с мелкими некротическими участками (И. Т. Шевченко). Макроскопически слизистая оболочка представляется покрасневшей, отечной, тусклой, местами бывают видны мелкие точечные эрозии. Складки слизистой утолщаются, становятся менее эластичными, число их уменьшается, в некоторых случаях они вообще перестают дифференцироваться.
Эти морфологические изменения в зависимости от этиологических и патогенетических факторов могут развиваться на одной какой-либо стенке пищевода или переходить на другие стенки, захватывая их участки различной протяженности, локализуясь на любом уровне пищевода.
Тканевые нарушения в стенке пищевода часто могут не выявляться при эзофагоскопическом исследовании; в других же случаях наблюдаются местные очаги гиперемии с экхимозами или без них, отечность и разрыхление слизистой оболочки, наличие более или менее вязкой слизи, иногда слизисто-гнойной или прозрачной, стекловидной массы (Г. С. Беленький).
Читайте также:

