Наночастицы для диагностики рака
В медицинских технологиях все чаще используются материалы с линейными размерами в несколько нанометров. Фармацевтические компании используют нанотехнологии в разработке систем диагностики и доставки лекарственных веществ к органам и тканям. Эти препараты дают сегодня больше половины всего оборота в мировой наномедицине. Одна из ведущих областей применения таких систем — онкология.
Достижение эффекта возможно путем повышения селективности лечения, то есть способности избирательно воздействовать именно на новообразование, не затрагивая близлежащие здоровые ткани. Кроме того, для увеличения эффективности диагностики и терапии рака препарат должен обладать максимальной способностью преодолевать естественные биологические барьеры при достижении злокачественных клеток.
За основу нашего препарата мы берем керамические наноантенны — высокоэлектроноплотные наноразмерные объекты. Если проще, это наночастицы соединений металлов с высоким атомным зарядом (номер по периодической таблице Д. И. Менделеева), обладающие биоинертностью. К таким материалам относятся, например, оксиды гафния и тантала. Наибольшей эффективностью будут обладать частицы размером не более 50 нм с высокой степенью кристалличности ядра. Керамические наноантенны обладают рядом уникальных физико-химико-биологических характеристик.

Отличительная особенность наночастиц, составляющих наноантенны для тераностики,— в том, что они одновременно и контрастное вещество для рентгеновской компьютерной томографии (радиодиагностика), и радиосенсибилизатор (радиотерапия). Такие свойства им придает тот самый металл с высоким атомным номером.
Помимо этого такие наночастицы могут служить платформой для создания мультифункциональных препаратов, сочетающих в себе различные способы лечения и визуализации заболеваний, а также адресной доставки наночастиц в опухоль. Вводя новые структурные элементы в нанопрепарат, можно собирать из них, будто из конструктора лего, в котором каждая деталька будет отвечать за определенные функции. Так, например, в нашей работе мы поставили себе цель получить частицы с настраиваемыми люминесцентными свойствами за счет введения в их структуру различных редкоземельных элементов. Настраиваемые люминесцентные характеристики могут помочь решать узкие задачи при визуализации опухолей, повысить точность обнаружения раковых клеток. Особенно перспективной для биовизуализации является апконверсионная люминесценция.


Механизм радиосенсибилизирующего действия связан с процессом образования свободных радикалов в результате испускания наноантеннами вторичного излучения при проведении лучевого лечения. Механизм действия на клетку ионизирующего излучения (рентгеновского, гамма-, электронного) связан с ионизацией клеточных органелл или воды. Данный процесс, называемый радиолизом, вызывает образование активных форм кислорода и свободных гидроксильных радикалов. Их взаимодействие с ДНК и клеточными структурами вызывает апоптоз — гибель злокачественной клетки.

Таким образом, в перспективе разработка препаратов для онкологической нанотераностики позволит увеличить эффективность диагностики и терапии онкологических заболеваний и заложить основу для создания препаратов персонифицированной медицины. Такой подход поможет повысить выживаемость онкологических больных за счет снижения влияния на организм побочных эффектов. А также тераностика благодаря объединению дорогостоящих процедур в одну сможет сэкономить затраты на дорогостоящее лечение, что, несомненно, подчеркивает доступность высококачественного лечения для каждого пациента.
Павел Кривошапкин, кандидат химических наук, доцент, директор научно-образовательного центра химического инжиниринга и биотехнологий Университета ИТМО

Фотодинамическая терапия (PDT) и магниторезонансная томография (MRI) широко применяются в лабораторных исследованиях и клинической практике для диагностики и лечения раковых опухолей. В этих двух подходах необходимо введение в организм некоторых специальных веществ: в случае PDT это красители (сенсибилизаторы), которые вызывают формирование активных форм кислорода в ответ на облучение светом; для MRI необходимы контрастирующие агенты, такие, как суперпарамагнитные частицы оксида железа. Кроме того, красители для PDT часто бывают токсичны для клеток сами по себе; в этом случае их заключают в частицы из биосовместимого материала, например, диоксида кремния.
Тайваньские ученые задались вопросом: почему бы не сконструировать универсальные частицы, пригодные как для магниторезонансной томографии, так и для фотодинамической терапии? Проблема состоит в том, что обычно наночастицы гасят люминесценцию красителя для PDT и, видимо, его способность генерировать активные формы кислорода. Исследователи показали, что в случае использования комплексов иридия(III) такого гашения не происходит. При этом сферические суперпарамагнитные частицы оксида железа размером 12 нм были покрыты диоксидом кремния (получились частицы диаметра 55 нм), в порах которого находилось комплексное соединение иридия(III) [Ir-(piq)2(ppTES)]-((EtO)3Si). Такие частицы сохранили и магнитные свойства, и способность к люминесценции.
Исследователи рассмотрели действие этих многофункциональных частиц на клетки карциномы шейки матки человека, HeLa. Клетки послушно накапливали наночастицы (рисунок 4), которые, похоже, сами по себе оказались нетоксичны: безо всяких прочих воздействий выживало около 100% клеток, как и в необработанном наночастицами контроле.
Авторы показали, что частицы пригодны для MRI, PDT и в качестве флуоресцентного красителя. В планах на будущее – повысить стабильность этих замечательных композитных наночастиц в растворах с высокой ионной силой, а также улучшить накопление частиц в клетках.
NAME] => URL исходной статьи [
Ссылка на публикацию: Нанометр

Фотодинамическая терапия (PDT) и магниторезонансная томография (MRI) широко применяются в лабораторных исследованиях и клинической практике для диагностики и лечения раковых опухолей. В этих двух подходах необходимо введение в организм некоторых специальных веществ: в случае PDT это красители (сенсибилизаторы), которые вызывают формирование активных форм кислорода в ответ на облучение светом; для MRI необходимы контрастирующие агенты, такие, как суперпарамагнитные частицы оксида железа. Кроме того, красители для PDT часто бывают токсичны для клеток сами по себе; в этом случае их заключают в частицы из биосовместимого материала, например, диоксида кремния.
Тайваньские ученые задались вопросом: почему бы не сконструировать универсальные частицы, пригодные как для магниторезонансной томографии, так и для фотодинамической терапии? Проблема состоит в том, что обычно наночастицы гасят люминесценцию красителя для PDT и, видимо, его способность генерировать активные формы кислорода. Исследователи показали, что в случае использования комплексов иридия(III) такого гашения не происходит. При этом сферические суперпарамагнитные частицы оксида железа размером 12 нм были покрыты диоксидом кремния (получились частицы диаметра 55 нм), в порах которого находилось комплексное соединение иридия(III) [Ir-(piq)2(ppTES)]-((EtO)3Si). Такие частицы сохранили и магнитные свойства, и способность к люминесценции.
Исследователи рассмотрели действие этих многофункциональных частиц на клетки карциномы шейки матки человека, HeLa. Клетки послушно накапливали наночастицы (рисунок 4), которые, похоже, сами по себе оказались нетоксичны: безо всяких прочих воздействий выживало около 100% клеток, как и в необработанном наночастицами контроле.
Авторы показали, что частицы пригодны для MRI, PDT и в качестве флуоресцентного красителя. В планах на будущее – повысить стабильность этих замечательных композитных наночастиц в растворах с высокой ионной силой, а также улучшить накопление частиц в клетках.
Исследователи из США, Японии и Вьетнама внедрили в извлечённую опухоль яичников наночастицы и подвергли мощному рентгеновскому облучению
По статистике Всемирной организации здравоохранения, заболеваемость раком из года в год растёт. В прошлом году от карциномы (вид злокачественной опухоли) погибли 10 миллионов человек. Это население средней европейской страны.
Статистика смертности показала, что после заболеваний сердечно-сосудистой и дыхательной систем рак – самая опасная болезнь в мире. Несмотря на это, врачи из разных стран мира работают над новыми методами лечения карциномы.
Один из последних методов разработала группа учёных из Японии, Вьетнама и США. Они изобрели наночастицы, которые при обычном рентгене создают пучки электронов. Эти наночастицы способны точечно уничтожать раковые опухоли.
Фото: Kateryna Kon / Shutterstock.com
Наша методика позволит нам очень выборочно усиливать эффект от действия рентгеновского излучения на опухоль. Это ликвидирует главный недостаток современной лучевой терапии – очень небольшая часть ионизирующего излучения попадает в само новообразование,
– отмечает один из разработчиков Котаро Мацумото.
Последние опыты с применением наночастиц для борьбы с раком выявили два взаимодополняющих метода. Часть этих частиц доставляет токсины и другие опасные вещества в опухоль, не угрожая здоровым тканям.
Японский исследователь Мацумото и его партнёры изобрели ещё один способ использования этих наночастиц. Дело в том, что редкоземельные элементы (гадолиний), из которых сделаны наночастицы, поглощают рентгеновские лучи в очень маленькой части спектра. Когда гадолиний облучают рентгеном, он вырабатывает пучки электронов высоких энергий. Последние могут уничтожать белки, ДНК и другие важные молекулы на небольшом расстоянии от наночастиц.

Фото: Berti HANNA/Globallookpress
В данном исследовании сила рака используется против него. Известно, что раковые клетки обладают очень большим метаболизмом. Опухоль буквально высасывает силы из организма. Поражённые клетки в связи с этим стремительно поглощают наночастицы и накапливают их внутри себя. Благодаря этому свойству учёные смогли применить гадолиний и рентген для точечной ликвидации злокачественной опухоли.
Основываясь на этой теории, медики из трёх стран синтезировали полые сферы из кремния и наполнили их гадолинием. Наночастицы внедрили в заранее извлечённую опухоль яичников. Когда раковые клетки поглотили наносферы, их облучили мощным рентгеном. Операция длилась примерно час. И уже через два дня клетки рака умерли.
На днях стало известно ещё об одном методе борьбы с раком. Специалисты из Лондонского университета королевы Марии пришли к выводу, что комбинирование химиотерапии и иммунотерапии в разы повышает шансы на излечение трижды негативного рака – самого опасного вида рака груди у женщин.
Врачи открыли белок βGBP, который повышает иммунитет, уничтожающий раковые клетки. Этот белок не только атакует и разрушает злокачественные клетки, но и гарантирует на долгое время защиту от рецидива.

Рак является причиной смерти №1 в мире.
На протяжении долгих десятилетий ученые разрабатывают противоопухолевые вакцины, вирусы, наночастицы и иммунотерапию для лечения рака.
Но насколько мы близки к победе над смертельной болезнью?
Всемирная организация здравоохранения (ВОЗ) отмечает, что каждая шестая смерть на планете связана с онкологическими заболеваниями. Только в России за 2015 году от рака умерло почти 287 тысяч человек, в США — почти 600 тысяч.
Сегодня наиболее распространенными видами лечения рака являются лучевая терапия, химиотерапия, хирургическое лечение и — в случае рака предстательной железы и рака молочной железы — еще и гормональная терапия.
На фоне традиционного лечения набирают силу новые, способные существенно улучшить результаты, а зачастую имеющие меньше побочных эффектов.
- Побочные эффекты агрессивной терапии
- Частые рецидивы заболевания после операции
- Устойчивость опухолей к химиопрепаратам
Сегодня мы расскажем о самых последних исследованиях рака, которые позволяют надеяться на скорую победу над болезнью и появление эффективной профилактики.
Иммунотерапия рака
Если раньше наука оказалась бы бессильной, то сегодня ответ нашелся быстро: новые препараты для иммунотерапии рака блокируют молекулы, маскирующие опухоль, тем самым полностью восстанавливая контроль иммунной системы над болезнью.
Терапевтические вирусы и вакцины против рака
В январе 2018 мы рассказывали о достижении швейцарских ученых, которые обучают дендритные вакцины прямо в теле пациента. Для этого достаточно ввести в клетку особые пузырьки (везикулы) с антигенами рака, и она начинает распознавать чужака.
В последнее время врачи понимают, что иммунотерапия наилучшим образом работает в тандеме с химиотерапией. Особенно, если курс химиотерапии предшествует назначению иммунотерапевтических средств. Проблема заключается в том, что эта комбинация увеличивает вероятность побочных эффектов.
Ученые из двух ведущих институтов Северной Каролины (США) нашли решение. Разработанный в начале 2018 года гелеобразный материал может использоваться для доставки химиотерапии и иммунотерапии в опухоль, без системных реакций.
Наночастицы доставляют химиопрепараты
Если говорить о точности доставки химиопрепаратов и обнаружении невидимых микроопухолей, то настоящую революцию в этом деле произвели нанотехнологии.
Наночастицы — это крошечные частицы, соизмеримые по своим размерам с молекулами. Они широко используются в разных областях медицины, включая диагностику и лечение рака. По мнению ведущих онкологов США, следующие 10 лет сделают наночастицы повседневной реальностью онкологии.
В чем секрет их успеха?
Начнем с главного: убить рак огромной дозой токсичного химиопрепарата, в принципе, не проблема. Проблема — не убить при этом человека.
Наночастицы служат идеальными транспортными средствами для доставки химиотерапевтических средств по нужному адресу. Чем точнее доставка яда, тем меньше его потребуется для лечения.
Тем ниже риск общих (системных) побочных явлений.
Но есть и другие области применения наночастиц. Например, их можно использовать для гипертермии, когда частицы сначала насыщают опухоли, а затем под действием внешнего излучения нагреваются, вызывая массовую гибель раковых клеток.
Врачи заставят рак голодать
Другая стратегия, недавно предложенная учеными – лишать рак питательных веществ, необходимых для бесконтрольного деления клеток и роста опухоли.
Авторы первого проекта научились лишать рак глутамина – жизненно важной аминокислоты, которую активно используют опухоли легких, груди и кишечника. Блокируя доступ клеток к глутамину, исследователям удалось усилить окислительный стресс и уменьшить опухоли.
Второй способ победить рак молочной железы – это лишить опухолевые клетки эссенциального фермента, который помогает им вырабатывать энергию.
Что обещают нам исследования рака?
Исследования рака проводятся на полной скорости, с применением всех доступных технических достижений Большинство из этих проектов все еще находятся на ранней стадии экспериментов in vitro и in vivo. Им предстоит пройти долгий путь до клинических испытаний на пациентах.
Это не значит, что мы должны потерять надежду.
Медицина находится на том этапе, где можно утверждать: рак излечим.
Остальное – это вопрос техники и нескольких лет времени.
Константин Моканов: магистр фармации и профессиональный медицинский переводчик
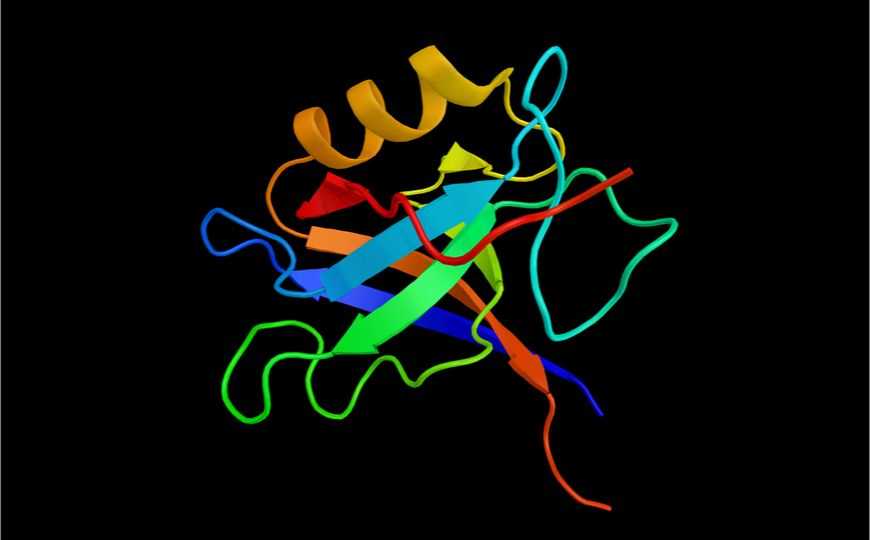
HER2 — один из рецепторов эпидермального фактора роста, который при связывании лиганда формирует гомодимеры или гетеродимеры с членами своего семейства и фосфорилирует молекулу-партнера для дальнейшей передачи сигнала. Известно, что в более 20% случаев рака молочной железы происходит усиление экспрессии HER2 (HER2 + ), он димеризуется, в результате чего клетки постоянно получают пролиферативный стимул. Такие опухоли лечат комбинированной терапией, в которую входят антитела к HER2 и ингибиторы его киназного домена.
Группа исследователей из Китая и Америки под руководством Ли Ванга (Национальный центр нанонауки и технологий, Пекин) и Кита Лэма (Калифорнийский университет в Дейвисе) предложили более простой способ лечения HER2 + опухолей. Они разработали трансформирующийся белковый мономер — пептид, который собирается в наночастицы (NP) в растворе и превращается в нанофибриллы при связывании с HER2 на поверхности опухолевых клеток. Пептид состоит из трех частей: флуоресцирующего бис-пиренового участка, домена, формирующего бета-листы, и HER2-связывающего домена. Первые два образуют гидрофобное ядро наночастицы, последний — отрицательно заряженное гидрофильное окружение.
Для тестирования наночастиц авторы статьи синтезировали контрольные пептиды, также образующие наночастицы, но без HER2-связывающего домена и/или без домена, формирующего бета-листы. При инкубации in vitro опытных наночастиц (NPs1) с внеклеточным доменом HER2 они постепенно формировали фибриллярную сеть в течение 24 часов, что показано при помощи сканирующей электронной микроскопии.
Исследователи инкубировали NPs1 с HER2 + клеточными культурами: наночастицы образовывали сеть вокруг клеток. После ученые оценивали цитотоксичность NPs1 с помощью МТТ-теста: уровень клеточной гибели коррелировал с дозой частиц. Оказалось, что сеть из NPs1, связываясь с HER2, ингибировала димеризацию рецептора, его активацию и передачу митогенного сигнала. Происходила остановка MAP-киназного сигнального каскада, который стимулирует деление клеток: снижался уровень фосфорилирования его основных участников. Также в опухолевых клетках происходила индукция апоптоза. В случае контрольных наночастиц таких изменений не было.
Далее авторы провели in vivo эксперименты с наночастицами. Они оценили распределение NPs1 в организме мыши: через 10 часов после введения наночастицы присутствовали в нормальных органах, но потом уходили. А в опухолях высокий уровень NPs1 сохранялся и через 10 дней, что объяснили образованием нанофибрилл вокруг клеток. Для анализа терапевтического эффекта исследователи сделали 8 инъекций в хвостовую вену и оценивали объем опухоли и жизнеспособность животных. В опытной группе объем опухоли снижался вплоть до полного исчезновения, такие мыши выживали, побочных эффектов не было. Контрольные животные погибали в течение 60 дней после начала инъекций, объем их опухолей увеличивался. Гистологические исследования опухолей опытной группы показали образование сети и гибель клеток.
Авторы считают, что положительный терапевтический эффект NPs1 требует дальнейших доклинических испытаний метода против HER2 + вариантов опухолей. Подобную концепцию наночастиц-нанофибрилл можно применить и к другим рецепторам, характерным для опухолей.
Lu Zhang et al. // Transformable peptide nanoparticles arrest HER2 signalling and cause cancer cell death in vivo. // Nature Nanotechnology, 2020; DOI: 10.1038/s41565-019-0626-4
ТАСС, 30 сентября. Исследователи из Японии, США и Вьетнама создали наночастицы, которые генерируют пучки электронов при облучении почти безобидным для организма рентгеновским излучением. Их можно использовать для "точечного" уничтожения раковых опухолей. Об этом ученые говорят в статье, которую опубликовал научный журнал Nature Communications.
"Наша методика позволит нам очень выборочно усиливать эффект от действия рентгеновского излучения на опухоль. Это ликвидирует главный недостаток современной лучевой терапии - очень небольшая часть ионизирующего излучения попадает в само новообразование", - рассказал один из авторов исследования Котаро Мацумото из Киотского университета (Япония).
Относительно недавно и зарубежные, и отечественные исследователи начали изучать, как можно использовать наночастицы для борьбы с раком и другими болезнями. Эти опыты показали, что их можно применять двумя путями. С одной стороны, наночастицы могут очень избирательно доставлять токсины или другие опасные вещества в опухоль или очаг инфекции, не затрагивая здоровые ткани.
При этом другие типы наночастиц могут играть роль "киллера" раковых клеток или микробов сами по себе. Такие наночастицы проникают внутрь них или прикрепляются к ним и служат "мишенью" для иммунитета, заставляя его клетки убивать опухоль или бактерий, или же на них наводится излучение лазера или магнитные поля. Частицы поглощают их энергию, разогреваются и в буквальном смысле "выжигают" новообразование.
Троянский конь для рака
Мацумото и его коллеги нашли новое применение для этих наночастиц, воспользовавшись тем, что некоторые редкоземельные элементы, такие как гадолиний, могут поглощать рентгеновские лучи в очень узкой части спектра. При облучении подобной формой рентгена они начинают вырабатывать пучки электронов высоких энергий, которые могут разрушать ДНК, белки и другие жизненно важные молекулы на небольшом расстоянии от гадолиния.
С другой стороны, раковые клетки благодаря высокой скорости метаболизма и различным нарушениям в работе их генов очень активно поглощают любые наночастицы и скапливают их внутри себя. Это, как предположили ученые, позволяет использовать гадолиний и рентгеновские лучи для очень точечного и безопасного уничтожения раковых опухолей.
Руководствуясь этой идеей, японские исследователи и их коллеги из Вьетнама и США синтезировали полые сферы из кремния и заполнили их гадолинием. Они ввели наночастицы в питательную среду, где жили раковые клетки, которых извлекли из опухоли яичников. Когда те поглотили наносферы, ученые облучили их пучком жесткого рентгеновского излучения.
Для того, чтобы все раковые клетки погибли через два дня после начала эксперимента, хватило всего 60 минут облучения. Другие формы рентгеновских лучей при этом никак не влияли на их жизнедеятельность и не приводили к массовой гибели клеток. Эта особенность наночастиц, как объясняет Мацумото, позволит пациентам одновременно проходить лучевую терапию и использовать рентген в других медицинских целях.
Аналогичных результатов ученые достигли в опытах на миниатюрных "заготовках" опухолей, которые были выращены из таких же клеток. Все это, по словам медиков, оставляет большие надежды на то, что подобный подход позволит сделать лучевую терапию гораздо более эффективной и безопасной для пациентов уже в самое ближайшее время.
Ученые из Массачусетского Технологического Института (Massachusetts Institute of Technology, сокращенно MIT, США) создали наночастицы, которые стимулируют противоопухолевый иммунитет и повышают эффективность иммунопрепаратов из группы ингибиторов контрольных точек.
Иммунотерапия — современное направление в лечении рака, которое предполагает использование ресурсов иммунной системы для уничтожения опухолевых клеток. Особенно успешно применяются иммунопрепараты из группы ингибиторов контрольных точек. Они помогают повысить выживаемость пациентов с поздними стадиями рака. Проблема в том, что у части онкобольных эти препараты неэффективны.
Специалисты из MIT создали наночастицы, которые стимулируют иммунитет, и вводили их мышам с искусственно вызванными злокачественными опухолями в комбинации с ингибиторами контрольных точек. Эффективность такого лечения оказалась значительно выше, чем терапия ингибиторами контрольных точек без наночастиц.
Доктор Колин Басс (Colin Buss), ведущий автор исследования, отмечает:
Эти методы лечения [иммунотерапия ингибиторами контрольных точек] хорошо работают у небольшой части пациентов, а у других пациентов они вообще не работают. На данный момент не совсем понятно, почему существует такая большая разница.
Ученые надеются, что созданные ими наночастицы в будущем помогут повысить эффективность иммунопрепаратов.
Наночастицы представляют собой упакованные небольшие отрезки ДНК. Они активируют иммунную реакцию против опухолевых клеток и, таким образом, работают в синергии с ингибиторами контрольных точек.
Отключить тормоза
Предыдущие клинические исследования с олигонуклеотидами не увенчались успехом, потому что эти молекулы плохо достигают раковых клеток и не накапливаются в опухолевой ткани. Специалисты из MIT упаковали фрагменты ДНК в пептиды, которые могут специфически присоединяться к раковым клеткам и проникать в них.
Два препарата усиливают друг друга
Ученые провели эксперименты на мышах с разными типами злокачественных опухолей. Животных поделили на три группы, в которых проводили разное лечение:
- Только ингибиторами контрольных точек.
- Только наночастицами с олигонуклеотидами.
- Комбинацией двух препаратов.
Наилучшие результаты получились в группе, где применяли сразу два препарата.
Далее исследователи решили проверить, можно ли лечить таким способом рак с метастазами. Мышам имплантировали по две опухоли в разные части тела, затем им вводили системно ингибиторы контрольных точек, а наночастицы — локально только в одну из опухолей. После этого активированные успешно уничтожали и второе новообразование. То есть, стимулируя иммунитет только в одном месте, можно получить системный ответ.
Теперь, когда эффективность наночастиц доказана, нужно проверить их безопасность. После этого, если испытания пройдут успешно, можно будет планировать клинические испытания с участием онкологических больных. Специалисты из MIT надеются, что их разработка поможет пациентам, у которых неэффективна терапия ингибиторами контрольных точек.
В Европейской клинике применяются все новейшие иммунопрепараты, зарегистрированные на территории России. Мы закупаем только оригинальные лекарственные средства с доказанной эффективностью у ведущих производителей. Все иммунопрепараты в наличии, лечение может быть начато в кратчайшие сроки после поступления пациента в клинику.
Уникальный препарат на основе наночастиц, совмещающий в себе диагностику и терапию раковых опухолей, разработан российскими учеными Института биоорганической химии. Многофункциональное лекарство способно найти клетки опухоли в организме, селективно соединиться с ними и обеспечить их уничтожение под действием внешнего поля. Пока препарат прошел испытания in vitro, на очереди in vivo стадия.
Сотрудники лаборатории молекулярной иммунологии Института биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова РАН смогли создать многофункциональный препарат на основе сшитых белками наночастиц, который способен самостоятельно идентифицировать опухоль в организме, окрашивать ее, делая видимой для врача, а затем может уничтожать пораженные клетки под действием внешнего магнитного поля. Их работу публикует Proceedings of the National Academy of Sciences.
Авторский коллектив работы под руководством заведующего лабораторией члена-корреспондента РАН Сергея Михайловича Деева в целом очень молодой. Один из соавторов – молодой кандидат наук, другая – аспирантка, а вот первый автор работы Максим Никитин сейчас заканчивает шестой курс – магистратуру МФТИ в Долгопрудном.
– В чем новизна ваших разработок?
В принципе, создано довольно много препаратов на основе наночастиц, все они имеют свои достоинства и недостатки. В частности, наночастицы, конъюгированные (соединенные) с антителами, способны находить в организме раковые клетки и селективно присоединяться к ним. Если частицы флуоресцентны, то они могут быть использованы для диагностики злокачественных опухолей – они их специфически окрашивают. Если частицы магнитные, то они могут быть использованы для уничтожения опухолей или метастазов – под воздействием внешнего поля они, нагреваясь, убивают раковые клетки.
Таким образом, комбинация ценных свойств наночастиц позволяет получить препарат, работающий последовательно для диагностики, а затем для лечения опухоли.
На первом этапе такие многофункциональные структуры могли бы за счет антител распознать раковые клетки, а за счет флуоресцентных квантовых точек или полимерных частиц прокрасить опухоль, чтобы хирург видел, какой участок необходимо удалять. На втором этапе могут быть уничтожены метастазы – самое опасное проявление онкологического заболевания. Для этого используются магнитные наночастицы, входящие в состав тех же структур. Они разрушают оставшиеся раковые клетки под воздействием внешнего магнитного поля.
По сути, многофункциональность препарата достигается за счет совмещения в одной структуре разных частиц. Как в детском конструкторе, мы можем совмещать совершенно разные частицы в одном лекарстве.
Как объединяются эти частицы? Для этого мы используем два специальных сильно взаимодействующих друг с другом бактериальных белка – барназу и барстар. Один тип частиц конъюгирован с одним белком, другой тип – с другим. После смешения таких биоконъюгатов они прочно связываются, за счет чего в одной структуре можно объединить совершенно разные по размерам и химической природе агенты.
Наша работа, как и большая часть перспективных сегодня исследований, ведется на стыке наук – фактически, это и физика, и биология.
– Как проходило испытание препарата?
– На первом этапе исследования нами разрабатывался механизм самосборки частиц, и обеспечение успешной сборки было нашей промежуточной целью. На этом этапе речь еще не шла о терапии, но лишь об успешной разработке механизма, матрицы для комбинации разных частиц в одном препарате.
На второй стадии начались in vitro испытания наших частиц на клеточных культурах. Оказалось, что наш механизм работает весьма успешно.
К раковым клеткам были добавлены три функциональные структуры: магнитные, флуоресцентные и противоопухолевые (направленные на раковые клетки за счет антител). На первом этапе частицы успешно присоединились к рецепторам, специфически отличив клетки-мишени от других клеток.
– Как будет практически реализовываться работа такого препарата?
– В перспективе для каждого пациента можно будет подобрать отдельное лечение и свое собственное лекарство с нужным соотношением структурных единиц в нем. В зависимости от конкретной ситуации врач может решить, чему больше следует уделить внимание, например, диагностике или терапии, в случае данного конкретного пациента. Сообразно этому, за считанные минуты врач сможет скомбинировать необходимые модули в многофункциональные структуры, пользуясь препаратами из 20 баночек, стоящих на столе.
Практическое применение таких препаратов для лечения – пока еще отдаленные планы. Однако исследования полученных многофункциональных препаратов in vivo уже ведутся – мы проверяем, годятся ли они для диагностики и лечения опухолей у мышей и крыс, а также смотрим, что происходит с наночастицами в живых организмах.
– Как велась подготовка к публикации полученных данных?
Читайте также: