Молекулярная диагностика рака шейки матки
VIII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИЕ И ИММУНОЛОГИЧЕСКИЕ МЕТОДЫ В ПРАКТИЧЕСКОЙ ДИАГНОСТИКЕ РАКА ШЕЙКИ МАТКИ
С.А. Сельков, Г.Н. Веденеева, С.В. Рищук
ГУ НИИАГ им. Д.О. Отта РАМН, Санкт-Петербург
Рак шейки матки (РШМ) занимает ведущее место в структуре женской онкологической заболеваемости и смертности в развивающихся странах и стабильное третье-четвертое место (после рака молочной железы, рака яичников, рака эндометрия) в экономически развитых странах [1]. В целом по распространенности РШМ занимает второе место после рака молочной железы. По данным ВОЗ ежегодно в мире регистрируется около 450 тыс. новых случаев РШМ [2]. Ежегодно только в странах Европейского сообщества отмечается более 25 тыс. новых случаев заболеваний и около 12 тыс. летальных исходов, связанных с РШМ [3]. В последние годы в экономически развитых странах отмечен рост заболеваемости РШМ среди женщин молодого и среднего возраста [2].
В России в настоящее время ежегодная заболеваемость РШМ составляет 14,9 на 100 тыс. женщин [5]. В Санкт-Петербурге среди злокачественных новообразований женских гениталий РШМ занимает третье место после рака эндометрия и рака яичников, тогда как в России в целом остается на втором, уступая только раку эндометрия [6]. Более 40% женщин с установленным диагнозом инвазивного РШМ умирают от прогрессирования заболевания в течение первых 5 лет с момента установления диагноза [7].
В сложной и разветвленной проблеме РШМ центральное место занимают три основных направления:
- разработка патогенетически обоснованных методов ранней диагностики и профилактики;
- усовершенствование методов лечения и прогнозирования течения предопухолевых заболеваний шейки матки и преинвазивного рака;
- повышение эффективности лечения инвазивного рака.
Особенно актуальным для РШМ является первое положение. Для РШМ, как ни для какого вида опухолей, разработаны методы скрининговой диагностики, позволяющие диагностировать неопластические процессы уже на самых ранних стадиях. При этом развитие одного из самых важных – цитологического метода - позволило еще в 60-е годы утверждать, что в ближайшем будущем женщины не должны умирать от РШМ, поскольку неопластические процессы будут выявляться на самых ранних доинвазивных стадиях.
Важной предпосылкой для реализации этого положения является разработка и внедрение вирусологических и молекулярно-биологических методов диагностики, позволяющих определить онкогенные папилломавирусы.
Большое внимание в последние годы уделяется и иммунологическим аспектам возникновения РШМ, поскольку одной из основных функций иммунной системы является элиминация опухолевых клеток.
В настоящее время считается общепризнанной роль онкогенных папилломавирусов (HPV) в этиопатогенезе РШМ. При многочисленных мультицентровых обследованиях женщин, страдающих РШМ, инфицированность онкогенными папилломавирусами наблюдалась более чем в 95% случаев [8, 9].
Решающее значение для развития РШМ имеет персистенция вирусного генома. Вирусные ДНК способны персистировать в клетке в эписомальной и интегративной формах. В тканях эпителиальных дисплазий шейки матки обнаруживаются эписомальные формы ДНК HPV. В большинстве случаев РШМ и в клеточных линиях, полученных из РШМ и содержащих HPV, вирусные последовательности определяются в интегрированной форме. Имеются сообщения об обнаружении вирусной ДНК в клетках РШМ как в интегрированной, так и в эписомальной формах [11].
Теоретические и экспериментальные исследования, посвященные роли HPV в развитии РШМ, дали толчок для разработки практических подходов, связанных с использованием молекулярно-биологическх методов ранней диагностики РШМ. К ним, прежде всего, относятся полимеразная цепная реакция (ПЦР) с типоспецифическими и видоспецифическими праймерами и так называемая молекулярная гибридизация II поколения (Hybrid Capture II).
Основным принципом ПЦР является многократное копирование определенного участка вирусной ДНК, что позволяет визуализировать продукты реакции в электрофорезе в полиакриламидном или агарозном геле при окраске бромистым этидием и подсветке ультрафиолетом.
Основным принципом Hybrid Capture II является формирование специфических ДНК-ДНК гибридов, улавливаемых антителами, фиксированными на лунках планшета. Использование хемилюминесцентной метки позволяет проводить не только качественную, но и количественную оценку результатов.
Полученные нами данные, представленные в табл. 1, свидетельствуют о разной чувствительности этих методов [12].
Таблица 1.
Частота инфицирования онкогенными типами HPV по данным обследования методом Hybrid Capture II и ПЦР.
| Метод диагностики | Hybrid Capture II | ПЦР | ||
|---|---|---|---|---|
| Группы больных | Количество больных | HPV (+) | Количество больных | HPV (+) |
| 1 группа | 413 | 119 (28,8%) | 181 | 66 (36,5%) |
| 2 группа | 57 | 4 (7%) | 78 | 9 (11,5%) |
| Всего: | 470 | 123 (26,2%) | 259 | 75 (28,9%) |
Наш опыт использования молекулярно-биологических методов для выявления папилломавирусов позволяет дать их сравнительную оценку. Так, ПЦР, обладая большей чувствительностью, несколько чаще дает так называемые ложно-позитивные результаты. В то же время, молекулярная гибридизация II поколения при большей ее технологичности до настоящего времени остается весьма дорогостоящим методом, так и не получившим широкого распространения в нашей стране.
Одним из ключевых положений, характеризующих молекулярные механизмы опухолевой трансформации при инфицировании онкогенными папилломавирусами, является оценка экспрессии генов Е2 и Е6 [13]. Использование количественной ПЦР в реальном времени с целью анализа физического состояния ДНК HPV позволило высказать следующее допущение:
- после интеграции преимущественное разрушение Е2 генов приводит к отсутствию последовательностей Е2 генов в продуктах ПЦР;
- количество копий обоих генов должно быть одинаковым в эписомальной форме;
- в конкоминантной форме количество копий Е2 генов должно быть меньше, чем Е6 генов.
- массовое цитологическое обследование женщин на профилактических осмотрах;
- углубленная диагностика при выявлении патологии (кольпоскопия, биопсия).
Успех цитологического скрининга рака шейки матки зависит от его организации. До настоящего времени не решен вопрос о возрастном составе населения, подлежащего цитологическому скринингу, и периодичности его проведения. В различных странах интервалы между скринингами колеблются от 1 года до 5 лет. По нашему мнению, интервал между цитологическими скринингами не должен превышать 2-3 лет, и обследование должны проходить все женщины с возраста начала половой жизни, оптимально - с 20 до 65 лет.
Эффективность цитологического скрининга во многом зависит от его чувствительности и колеблется от 66% до 83% [14]. Причиной ложноотрицательных ответов остается не столько ошибочная интерпретация цитологических данных, сколько плохой забор материала для цитологического исследования. Не менее важным является проведение второго этапа обследования, а именно прицельной биопсии в случае обнаружения патологии при цитологическом исследовании [15].
В определенной степени цитологический и молекулярно-биологический методы сближает иммуноцитохимический (ИЦХ) метод, основанный на определении капсоидных белков HPV с помощью моноклональных антител S33 и Т16. Распознаваемый моноклональным скрининговым антителом S33 эпитоп консервативен и дает возможность идентификации почти всех типов HPV. Эпитоп, распознаваемый моноклональным антителом Т16, напротив, консервативен для HPV 16 и 18 типов, имеющих склонность к злокачественной трансформации эпителия. Эффективность иммуноцитохимического исследования для оценки активной фазы папилломавирусной инфекции была сопоставлена нами с помощью еще одного молекулярно-биологического метода – так называемой обратно транскриптазной ПЦР (ОТ ПЦР) (табл. 2).
Для пациенток с положительными результатами иммуноцитохимического исследования прогрессия CIN более вероятна, чем элиминация HPV и регрессия дисплазии.
Таким образом, определение активной фазы папилломавирусной инфекции может служить дополнительным критерием прогрессирования дисплазий и поводом для более энергичных методов терапии [16].
Следует отметить, что развитие РШМ – вероятностный процесс, зависящий не только от инфицирования онкогенными папилломавирусами но и от целого ряда экзо- и эндогенных факторов. Безусловно, среди эндогенных сопутствующих факторов важнейшее значение имеет фоновая патология шейки матки, предрасполагающая к персистированию папилломавирусов. Полученные нами данные свидетельствуют о высокой ее частоте у женщин, инфицированных онкогенными типами папилломавирусов (табл. 3) [17].
Таблица 2.
Оценка эффективности ИЦХ и ОТ ПЦР при определении репродуктивной фазы HPV-инфекции.
| Группы | Скрининг | HPV 16/18 | ||||
|---|---|---|---|---|---|---|
| ПЦР (+) | ИЦХ (+) | ОТ ПЦР(+) | ПЦР (+) | ИЦХ (+) | ОТ ПЦР (+) | |
| Без атипии | 3 (7,5%) | 1 (33,3%) | 2 (66,7%) | 2 (28,6%) | 1 (50,0%) | 1 (50,0%) |
| CIN I | 17 (42,5%) | 5 (29,4%) | 9 (53,0%) | 15 (45,5%) | 5 (33,3%) | 6 (40,0%) |
| CIN II | 8 (20,0%) | - | - | 5 (45,5%) | - | - |
| CIN III | 4 (10,0%) | - | - | 3 (37,5%) | - | - |
| Ca in situ | 8 (20,0%) | - | - | 7 (70,0%) | - | - |
| Всего | 40 (100,0%) | 6 (15,0%) | 11 (27,5%) | 32 (46,4%) | 6 (18,75%) | 7 (21,9%) |
Таблица 3.
Характер фоновой цервикальной патологии у обследованных женщин.
| Фоновая цервикальная патология | ОТ ПЦР (+)(n=215) | ОТ ПЦР (-)(n=170) | P | ||
|---|---|---|---|---|---|
| n | M±m% | n | M±m% | ||
| Эндоцервицит | 49 | 22,8±5,6% | 40 | 23,5±6,4% | >0,1 |
| Эрозированный эктропион | 147 | 68,4±6,2% | 90 | 52,9±7,5% | 0,1 |
| Всего: | 208 | 96,7±2,3% | 137 | 80,6±5,6% | Поделиться | |
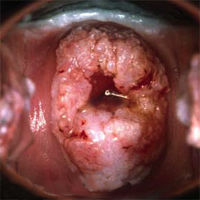
Рак шейки матки находится на третьем месте по распространенности среди всех раков у женщин. Ежегодно в мире по данным Международного агентства по изучению рака регистрируется 371 000 новых случаев РШМ и ежегодно же от РШМ умирает 190 000 женщин. В России каждые 17 минут от рака шейки матки умирает женщина.
Эпидемиологические исследования, неоднократно проводящиеся и отечественными, и зарубежными учеными, убедительно показали, что неоспоримым фактором риска возникновения предраковых изменений и рака шейки матки является папилломавирусная инфекция. Основным и наиболее перспективным направлением борьбы с этим заболеванием является его профилактика, которая заключается в своевременном выявлении средствами современной молекулярной диагностики высококанцерогенных вирусов папилломы человека (ВПЧ).
Вирусом заражаются 8 из 10 женщин, ведущих активную половую жизнь. Сама по себе инфекция вирусом папилломы человека – не заболевание. В большинстве случаев заражения иммунная система справляется с вирусом в течение года без какого-либо лечения. И только несколько процентов женщин с хронической (персистентной) ВПЧ-инфекцией попадают в группу риска по РШМ. При этом необходимо понимать, что на развитие онкологии влияет несколько факторов: тип вируса, его количество, сопутствующие заболевания матки и влагалища, общее состояние иммунитета. Эта инфекция - очень коварна, и связанные с нею предшествующие раку изменения не только не вызывают никакого беспокойства и дискомфорта, но часто не обнаруживаются при обычном осмотре у гинеколога. Тест на вирус папилломы человека (ВПЧ-тест) является надежным помощником врачу: выявление вируса обращает особое внимание врача на проблему возможного развития рака, вынуждает провести дополнительные обследования, которые могут однозначно определить, есть болезнь или нет.
Прежде всего – не паниковать. Обнаружение вируса еще не означает что у Вас рак. Просто Вы заранее предупреждены о том, что заболевание может появиться. Необходимо обратиться к врачу-гинекологу и провести дополнительные исследования, такие как онкоцитология (ПАП-тест) и кольпоскопия (детальный осмотр шейки матки под увеличением). При необходимости для установления точного диагноза может быть взят образец ткани (биоптат) для гистологического исследования.
В состав вакцины входят антигенные наборы указанных типов папилломавируса. После введения препарата наблюдается эффект выработки противовирусных антител, которые длительное время сохраняются в организме человека и обеспечивают иммунологическую защиту против ВПЧ. Механизм защиты основан на нейтрализующем действии антител в случае инфицирования человека вирусом. Антитела контактируют с антигеном вируса с формированием комплекса, который в дальнейшем уничтожается другими защитными клетками иммунной системы. Пораженные ВПЧ клетки, таким образом, разрушаются и удаляются из организма, что в конечном итоге не приводит к развитию патологического процесса. Чтобы эффект памяти существовал длительное время и происходила стимуляция B-лимфоцитов (клетки, в которых и происходит синтез антител к ВПЧ) вакцина вводится несколько раз. Положительный иммунологический эффект достигается почти в 100% случаев.
Еще одним важным звеном защитного действия вакцины является то, что возникает феномен перекрестной защиты в отношении высокоонкогенных типов ВПЧ, антигенный набор которых в самой вакцине не содержится. Эти типы 31, 33, 35, 39, 45, 51, 52, 56, 58 и 59. Тем самым, становиться возможным, предотвратить развитие рака шейки матки в 90-95% случаев.
Вакцина показана для применения детям и подросткам в возрасте: девочки от 7 до 17 лет, мальчики с 9 лет, молодым женщинам от 18 до 26 лет. Гардасил применятся по схеме 0 – 2 – 6 месяцев (курс состоит в трехкратном введении в указанные сроки). Существует и ускоренная схема, когда вторая доза вводится через 1 месяц после начала курса, а третья доза – через 3 месяца после второй.
Обследование на предмет ВПЧ, в первую очередь, преследует цель предупреждения и ранней диагностики рака шейки матки. Для этой цели мы приеняем метод ПЦР-диагностики, который позволяет диагностировать на ранних стадиях ДНК вирус папилломы человека с типированием различных серотипов.
Ульянова С.М., акушер-гинеколог, врач высшей категории.

Как проходит обследование
Алгоритм обследования состоит из двух этапов. На первом этапе проводится первичное обследование пациентки, куда входит, помимо сбора анамнеза и осмотра в зеркалах,
- цитологическое исследование — скрининговая методика, эффективность которой составляет более 85%. Я использую метод жидкостной цитологии — наиболее информативной сегодня, в ходе процедуры материал, взятый с поверхности шейки и шеечного канала, помещается в пробирку со специальной средой-стабилизатором. При необходимости подтверждения наличия вируса папилломы человека (ВПЧ) в дальнейшем этот материал может быть исследован для уточнения сведений, что экономит время, в случае назначения лечения можно также отслеживать результативность терапии.
- простая кольпоскопия — эндоскопическое исследование с использованием микроскопа, при котором изображение обследуемого участка увеличивается в 6-16 раз, что позволяет рассмотреть слизистую более детально, при этом патологически измененные ткани удается дифференцировать от нормальных.
При наличии подозрительных очагов, обнаруженных при визуальном осмотре, или при патологических изменениях, выявленных при цитологии, при неудовлетворительном результате анализа пациентка направляется на дальнейшее обследование. На втором этапе проводится:
- расширенная кольпоскопия — во время процедуры слизистая обрабатывается 3-5% раствором уксусной кислоты или раствором Люголя, что позволяет обнаружить патологически измененные клетки; эффективность метода достигает 70-80%;
- в случае необходимости проводится прицельная биопсия — взятие материала с подозрительных участков с последующим гистологическим исследованием. Эта методика остается решающий в диагностике и лечении рака шейки матки, поскольку позволяет не только распознать гистологию опухоли, определить злокачественность процесса, но также составить прогноз лечения.
- обследование на ВПЧ — основной причины развития рака шейки матки; у нас для идентификации вируса используются различные иммуноцитохимические и молекулярно-биологические методы: PCR, Hybrid Capture II и др.
- исследование на онкомаркер SCC (опухолевый антиген) — определение уровня антигена плоскоклеточной карциномы — специфического белка, не вырабатываемого здоровыми клетками; при наличии злокачественного образования его концентрация резко возрастает.
Инструментальная диагностика при раке шейки матки
В зависимости от имеющихся проявлений могут назначаться те или иные методы инструментальной диагностики, среди которых можно выделить:
- УЗИ — наиболее простой метод диагностики рака шейки матки, необходим для определения распространенности процесса;
- цервикогистероскопия — метод ранней диагностики рака шейки матки и других патологий, в ходе которого проводится раздельное диагностическое выскабливание (по показаниям) — взятие материала из цервикального канала и со слизистой матки;
- цистоскопия — визуальный осмотр внутренней поверхности мочевого пузыря с использованием эндоскопического оборудования, назначаемый при наличии опухоли более 4 см, если процесс затронул передний свод влагалища или у пациентки присутствуют соответствующие жалобы;
- ректороманоскопия — эндоскопическое исследование прямой кишки и нижних отделов сигмовидной при наличии опухоли более 4 см с вовлечением в процесс заднего свода влагалища.
- томография — КТ, МРТ — назначается пациенткам для оценки степени распространения процесса на другие структуры: тело матки, параметрий, органы брюшной и тазовой полости, лимфоузлы и др.
- ПЭТ/ПЭТ-КТ рекомендована для исключения распространения метастазов на лимфатические узлы, образования отдаленных метастазов;
- остеосцинтиграфия — показана при подозрении на метастазирование в кости;
Также может понадобиться рентгенологическое обследование органов грудной клетки, внутривенная урография и другие обследования. Для получения более полной картины заболевания пациентке назначаются лабораторные исследования крови (общий, биохимический, коагулограмма и др.). При онкологических заболеваниях важно комплексное обследование, от этого зависит дальнейшая тактика лечения, в том числе объем предстоящей операции. В нашей клинике пациенткам доступны все необходимые обследования.
Особенности лечения
Обратившись ко мне, каждая пациентка может рассчитывать на индивидуальный подход, тактику обследования и лечения я подбираю, учитывая множество нюансов: возраст, наличие сопутствующих патологий, перенесенные в прошлом оперативные вмешательства и т.п.
Мой опыт составляет более 400 удачно сделанных лапароскопических операций. Всем пациенткам я провожу малотравматичное вмешательство, используя лапароскопический доступ — все манипуляции выполняются через несколько сантиметровых проколов на передней брюшной стенке. Благодаря малотравматичности восстановление происходит быстрее, чем при проведении открытой операции. Используя оборудование последнего поколения, мне удается добиться максимальной эффективности, при этом само вмешательство — безопасно и непродолжительно.
Важным этапом является лимфаденэктомия. При оперативном вмешательстве, выполняемом большинством хирургов, после удаления лимфоузлов и сосудов происходит истечение большого количества лимфы в брюшную полость; чтобы лечить это осложнение необходима установка дренажа в полость малого таза на длительный срок. Чтобы отказаться от дренажей, я использую во время лимфодиссекции инструменты, с помощью которых удается надежно заварить сосуды (кровеносные и лимфатические). Таким образом, зона операции остается сухой, что позволяет провести все манипуляции с высокой точностью. В нашей клинике разработана и успешно применяется система Fast Track — хирургия быстрого восстановления: стрессовая реакция организма снижена, время пребывания в стационаре минимально.
Болезни шейки матки — одни из немногих, которые можно обнаружить при визуальном осмотре в ходе скринингового обследования. Поэтому я рекомендую всем женщинам проходить регулярные плановые осмотры — раз в год. При подозрении на рак шейки матки ранняя диагностика имеет решающее значение, при вовремя начатом лечении выздоровление возможно более чем у 90-95% пациенток.
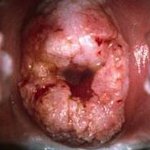
Рак шейки матки – опухолевое поражение нижнего отдела матки, характеризующееся злокачественной трансформацией покровного эпителия (экто- или эндоцервикса). Специфическим проявлениям рака шейки матки предшествует бессимптомное течение; в дальнейшем появляются контактные и межменструальные кровянистые выделения, боли в животе и крестце, отеки нижних конечностей, нарушения мочеиспускания и дефекации. Диагностика при раке шейки матки включает проведение осмотра в зеркалах, расширенной кольпоскопии, исследования цитологического соскоба, биопсии с гистологическим заключением, эндоцервикального кюретажа. Лечение рака шейки матки проводят с учетом гистологической формы и распространенности с помощью хирургического вмешательства, лучевой терапии, химиотерапии или их комбинации.
МКБ-10

- Причины РШМ
- Факторы риска
- Классификация
- Симптомы рака шейки матки
- Диагностика
- Лечение рака шейки матки
- Хирургическое лечение
- Противоопухолевое лечение
- Прогноз
- Профилактика
- Цены на лечение
Общие сведения
Причины РШМ
Среди других ИППП, повышающих риски развития рака шейки матки, выделяют генитальный герпес, цитомегаловирусную инфекцию, хламидиоз, ВИЧ. Из всего вышесказанного следует, что вероятность развития рака шейки матки больше у женщин, часто меняющих половых партнеров и пренебрегающих барьерными методами контрацепции. Кроме того, при раннем начале сексуальной жизни (в возрасте 14-18 лет) незрелый эпителий шейки матки обладает особой восприимчивостью к воздействию повреждающих агентов.
К факторам риска по развитию рака шейки матки относят ослабление функции иммунной системы, курение, возраст старше 40 лет, диеты с малым содержанием фруктов и овощей, ожирение, недостаток витаминов А и С. Также доказано, что вероятность развития рака шейки матки увеличивается при длительном (свыше 5 лет) приеме оральных контрацептивов, многочисленных родах, частых абортах. Одним из факторов позднего обнаружения рака шейки матки является низкая медицинская культура, нерегулярное прохождение женщинами профилактических осмотров с исследованием мазка из цервикального канала на онкоцитологию.
К фоновым заболеваниям, предрасполагающим к развитию рака шейки матки, в гинекологии относят лейкоплакию (интраэпителиальную неоплазию, CIN), эритроплакию, кондиломы, полипы, истинную эрозию и псевдоэрозию шейки матки, цервициты.
Классификация
По гистологическому типу, в соответствии с двумя видами эпителия, выстилающего шейку матки, различают плоскоклеточный цервикальный рак с локализацией в эктоцервиксе (85-95%) и аденокарциному, развивающуюся из эндоцервикса (5-15%). Плоскоклеточный рак шейки матки, в зависимости от степени дифференцировки, может быть ороговевающим, неороговевающим и низкодифференцированным. К редким гистотипам рака шейки матки относятся светлоклеточная, мелкоклеточная, мукоэпидермоидная и др. формы. С учетом типа роста различают экзофитные формы рака шейки матки и эндофитные, встречающиеся реже и имеющие худший прогноз.
Для оценки распространенности в клинической гинекологии используются классификации рака шейки матки по двум системам: FIGO, принятой Международной федерацией акушеров и гинекологов, и ТNМ (где T – распространенность опухоли; N – вовлеченность регионарных лимфоузлов; M – наличие отдаленных метастазов).
Стадия 0 (FIGO) или Тis (ТNМ) расценивается как преинвазивный или внутриэпителиальный рак шейки матки (in situ).
Стадия I (FIGO) или T1 (ТNМ) - опухолевая инвазия ограничивается шейкой матки, без перехода на ее тело.
- I A1 (T1 А1) – микроскопически определяемый рак шейки матки с глубиной инвазии до 3 мм с горизонтальным распространением до 7 мм;
- I A2 (T1 А2) – прорастание опухоли в шейку матки на глубину от 3 до 5 мм с горизонтальным распространением до 7 мм.
- I B1 (T1 В1) – макроскопически определяемый цервикальный рак, ограниченный шейкой матки, либо микроскопически выявляемые поражения, превышающие IA2 (T1А), не превышающее в максимальном измерении 4 см;
- I B2 (T1 В2) - макроскопически определяемое поражение, превышающее в максимальном измерении 4 см.
Стадия II (FIGO) или T2 (ТNМ) характеризуется распространением рака за пределы шейки матки; нижняя треть влагалища и стенки таза интактны.
- II A (T2 А) – опухоль инфильтрирует верхнюю и среднюю треть влагалища или тело матки без прорастания параметрия;
- II B (T2 В) – опухоль инфильтрирует параметрий, но не доходит до стенок таза.
Стадия III (FIGO) или T3 (ТNМ) характеризуется распространением рака за пределы шейки матки с прорастанием параметрия до стенок таза либо вовлечением нижней трети влагалища, либо развитием гидронефроза.
- III A (T3 А) – опухоль захватывает нижнюю треть влагалища, но не прорастает в стенки таза;
- III B (T3 В) – опухоль переходит на стенки таза либо вызывает гидронефроз, или вторичное поражение почки.
Стадия IV А (FIGO) или T4 (ТNМ) характеризуется распространением рака шейки матки в смежные органы либо распространением за пределы таза. Стадия IV B (T4 M1) свидетельствует о наличии отдаленных метастазов.
Симптомы рака шейки матки
При прорастании опухоли в стенки таза или нервные сплетения появляются боли в животе, под лоном, в крестце в покое или во время полового акта. В случае метастазирования рака шейки матки в тазовые лимфоузлы и сдавливания венозных сосудов могут наблюдаться отеки ног и наружных гениталий.
Если опухолевая инфильтрация затрагивает кишечник или мочевой пузырь, развиваются нарушения дефекации и мочеиспускания; появляется гематурия или примесь крови в кале; иногда возникают влагалищно-кишечные и влагалищно-пузырные свищи. Механическая компрессия метастатическими лимфоузлами мочеточников приводит к задержке мочи, формированию гидронефроза с последующим развитием анурии и уремии. К общим симптомам рака шейки матки относятся общая слабость, повышенная утомляемость, лихорадка, похудание.
Диагностика
Основу раннего выявления микроинвазивного цервикального рака составляют регулярные онкопрофилактические осмотры с цитологическим исследование соскоба шейки матки. Пап-тест (мазок по Папаниколау) позволяет выявлять предраковые процессы, раковые клетки при преинвазивном росте опухоли. Схема обследования включает:
- Осмотр шейки матки в зеркалах. Визуальный гинекологический осмотр в ранней стадии позволяет обнаружить или заподозрить РШМ по внешнем признакам: изъязвлениям, изменению окраски шейки матки. В инвазивной стадии при экзофитном типе роста рака на поверхности шейки матки определяются фибринозные наложения, опухолевидные разрастания красноватого, белесоватого, розовато-серого цвета, которые легко кровоточат при прикосновении. В случае эндофитного роста цервикального рака шейка становится увеличенной, приобретает бочковидную форму, неровную бугристую поверхность, неравномерную розово-мраморную окраску. При ректо-вагинальном исследовании в параметрии и малом тазу могут определяться инфильтраты.
- Кольпоскопия. С помощью кольпоскопии при увеличении изображения в 7,5- 40 раз возможно более детально изучить шейку матки, обнаружить фоновые процессы (дисплазию, лейкоплакию) и начальные проявления рака шейки матки. Для исследования зоны трансформации эпителия используют проведение пробы с уксусной кислотой и Шиллер-теста (йодной пробы). Атипия при раке шейки матки выявляется по характерной извитости сосудов, менее интенсивному окрашиванию патологических йоднегативных очагов. При подозрении на рак шейки матки показано исследование опухолеассоциированного антигена плоскоклеточных карцином – онкомаркера SCC (в норме не превышает 1,5 нг/мл).
- Биопсия шейки матки. Кольпоскопия дает возможность выявить участок трансформации и произвести прицельную биопсию шейки матки для гистологического исследования забранных тканей. Ножевая биопсия шейки матки с выскабливанием цервикального канала обязательна при подозрении на цервикальный рак. Для определения степени инвазии рака производится конизация шейки матки – конусовидное иссечение кусочка тканей. Решающим и окончательным методом в диагностике рака шейки матки является морфологическая интерпретация результатов биопсии.
Дополнительно при раке шейки матки проводится УЗИ малого таза, позволяющее стадировать опухолевый процесс и планировать объем вмешательства. Для исключения прорастания опухоли в смежные органы и отдаленного метастазирования прибегают к выполнению УЗИ мочевого пузыря и почек, цистоскопии, внутривенной урографии, УЗИ брюшной полости, рентгенографии легких, ирригоскопии, ректоскопии. При необходимости пациентки с выявленным раком шейки матки должны быть проконсультированы урологом, пульмонологом, проктологом.

Лечение рака шейки матки
Все операции при раке шейки матки делятся на органосохраняющие и радикальные. Выбор тактики зависит от возраста женщины, репродуктивных планов, распространенности онкопроцесса. В онкогинекологии применяется:
- Органосохраняющая тактика. При преинвазивном раке у молодых женщин, планирующих деторождение, выполняются щадящие вмешательства с удалением начально измененных участков шейки матки в пределах здоровых тканей. К таким операциям относят конусовидную ампутацию (конизацию) шейки матки, электрохирургическую петлевую эксцизию, высокую ампутацию шейки матки. Экономные резекции при раке шейки матки позволяют соблюсти онкологическую радикальность и сохранить репродуктивную функцию.
- Радикальная тактика. При более выраженных изменениях и распространенности опухолевого процесса показано удаление матки с транспозицией яичников (выведением их за пределы таза) или с овариэктомией. При раке шейки матки в стадии I B1 стандартным хирургическим объемом является пангистерэктомия – экстирпация матки с аднексэктомией и тазовой лимфодиссекцией. При переходе опухоли на влагалище показано проведение радикальной гистерэктомии с удалением части влагалища, яичников, маточных труб, измененных лимфоузлов, парацервикальной клетчатки.
Хирургический этап лечения рака шейки матки может сочетаться с лучевой или химиотерапией, либо с их комбинацией. Химио- и радиотерапия могут проводиться на дооперационном этапе для уменьшения размеров опухоли (неоадъювантная терапия) или после операции для уничтожения возможно оставшихся опухолевых тканей (адъювантная терапия). При запущенных формах рака шейки матки выполняются паллиативные операции – выведение цистостомы, колостомы, формирование обходных кишечных анастомозов.
Прогноз
Лечение рака шейки матки, начатое на I стадии, обеспечивает 5-летнюю выживаемость у 80-90% пациенток; при II ст. выживаемость через пять лет составляет 60-75%; при III ст. - 30-40%; при IV ст. – менее 10%. При осуществлении органосберегающих операций по поводу рака шейки матки шансы на деторождение сохраняются. В случае проведения радикальных вмешательств, неоадъювантной или адъювантной терапии фертильность полностью утрачивается.
При выявлении рака шейки матки при беременности, тактика зависит от сроков гестации и распространенности опухолевого процесса. Если срок гестации соответствует II-III триместру, беременность возможно сохранить. Ведение беременности при раке шейки матки осуществляется под повышенным медицинским наблюдением. Методом родоразрешения в этом случае обычно служит кесарево сечение с одновременным удалением матки. При сроке гестации менее 3-х месяцев производится искусственное прерывание беременности с немедленным началом лечения рака шейки матки.
Профилактика
Основной профилактической мерой рака является массовый онкологический скрининг с помощью цитологического исследования соскобов с шейки матки и из цервикального канала. Обследование рекомендуется начинать после начала половой жизни, но не позднее возраста 21 года. В течение первых двух лет мазок сдается ежегодно; затем, при отрицательных результатах – 1 раз в 2-3 года.
Профилактика рака шейки матки требует раннего выявления и лечения фоновых заболеваний и половых инфекций, ограничения числа сексуальных партнеров, использования барьерной контрацепции при случайных половых связях. Пациенткам групп риска необходимо прохождения осмотра гинеколога не реже 1 раза в полгода с проведением расширенной кольпоскопии и цитологического мазка. Девочкам и молодым женщинам в возрасте от 9 до 26 лет показано проведение профилактической вакцинации против ВПЧ и рака шейки матки препаратами Церварикс или Гардасил.
Читайте также:

