Лимфома ходжкина пример формулировки диагноза
На основании данных, полученных при опросе жалоб больного (лихорадка, потливость, зуд кожи), анамнеза заболевания, результатов объективного обследования (бледность кожи, увеличение лимфоузлов, спленомигалия), данных лабораторного исследования (лейкоцитоз с нейтрофидозом, эозинофилия, обнаружение в биоптате лимфоузла гранулем с гигантскими клетками Березовского - Штернберга, а так же после дифференциальной диагностики устанавливается развернутый окончательный диагноз. Отмечаются также сопутствующие заболевания и осложнения.
Диагноз лимфогранулематоза может ставиться на основании сочетания следующих клинических признаков:
1. Увеличение периферических лимфоузлов или лимфоузлов средостения
2. Наличие гранулем с клетками Березовского - Штернберга или Ходжкина при гистологическом исследовании узла.
Развернутый клинический диагноз формулируется в соответствии с общепринятыми классификациями. В диагнозе указывается основное заболевание с характеристикой гистологического типа, стадия заболевания, наличие (Б) или отсутствие (А) одного или нескольких симптомов интоксикации, отсутствие(а) или наличие (б) биологических признаков активности заболевания (повышенная СОЭ, нейтрофильный лейкоцитоз, гиперфибринагенемия, гипер-альфа2глобулинемия, низкое содержание сывороточного железа), а так же сопутствующие заболевания и осложнения.
В 1965 году была принята международная морфологическая классификация лимфогранулематоза, которая включает 4 гистологических типа: лимфогистиоцитарный, нодулярный склероз, смешанноклеточный вариант, лимфоидное истощение. Сущность патеногенеза лимфогранулематоза определяется опухолевой прогрессией, при этом из очагов поражения исчезают лимфоциты, что наглядно отражается в смене гистологических вариантов, которые в сущности являются фазами развития заболевания. Наиболее стабилен вариант нодулярного склероза.
В основу современной клинической классификации лимфогранулематоза положено постепенное распространение заболевания из первичного очага. Классификация принята на конференции в Ann Arbor (Сорбонна, 1971 г.).
Стадия 1 (локальные формы) — поражение лимфатических узлов одной или двух смежных областей.
Стадия 2 (регионарные формы) — поражение лимфатических узлов двух областей и более по одну сторну диафрагмы. Количество пораженных областей указывается арабской цифрой: II2.
Стадия 3 (генерализованные формы) — поражение лимфатических узлов любых областей по обе стороны диафрагмы III, может сопровождаться поражением селезенки.
Стадия 4 (диссеминированные формы) — диффузное поражение одного или более органов с поражением лимфоузлов или без них.
При морфологической верификации биопсированной ткани степень растпространенности процесса обозначается символами: N - лимфатические узлы, S - селезенка, H - печень, L - легкие, M - костный мозг, D - кожа, O - кости, P - плевра.
Примерная формулировка диагноза лимфогранулематоза.
1. Лимфогранулематоз, смешанноклеточный вариант, IIАа - стадия
2. Лимфогранулематоз, лимфоидное истощение, IV Бб - стадия (M+, S+, H+, L— , D—).
Примерная формулировка диагноза ЗНЛ.
1. Злокачественная неходжкинская лимфома низкой степени злокачественности, III Аа - стадия (N,S).
РЦРЗ (Республиканский центр развития здравоохранения МЗ РК)
Версия: Архив - Клинические протоколы МЗ РК - 2012 (Приказы №883, №165)
Общая информация
Лимфома Ходжкина – это злокачественная опухоль, первично возникающая в лимфатических узлах и распространяющаяся преимущественно по лимфатической системе путем лимфогенного метастазирования. (ВОЗ, 2001 г.).


Классификация
Диагностика
| Патология | Норма | > Патология |
| Лейкопения | Лейкоциты 4,0-9,09*10 9 /л | Лейкоцитоз |
| Анемия | Гемоглобин (М) 130,0-160, г/л, (Ж) 120-140 г/л | |
| Анемия | Эритроциты (М) 4,0-5,0*10 12 /л, (Ж) 3,9 -4,7*10 12 /л | Эритроцитоз |
| Тромбоцитопения | Тромбоциты 180-320* 10 9 /л | Тромбоцитоз |
| Скорость оседания эритроцитов (М) 2-15, (Ж) 2-10 | Ускоренное СОЭ |
Биохимический анализ крови (включая исследование креатинина, мочевины, билирубина, общего белка, трансаминаз, ЛДГ, щелочной фосфатазы).
| Норма | Патология |
| Общий белок 66-87 г/л | Гипопротеинения 45-50 г/л |
| Мочевина 2,3-8,3 ммоль/л | Выше 8,3 ммоль/л |
| Креатинин 45-115 ммоль/л | Выше 115 ммоль/л |
| АЛаТ до 0,68 (до 0,52) мг/л | Выше 0.68 мг/л |
| АСаТ до 0,62 (до 0,52) мккат/л | Выше 0.62мккат/л |
| Щелочная фосфатаза от 30 до 120 U/L | Выше 120 U/L |
| ЛДГ от 0 до 248 U/l | Выше 248 U/l |
| Билирубин до 22 мкмоль/л | Выше 22 мкмоль/л |
Дифференциальный диагноз
| Нозологии | Исследования | ||
| ОАК | Гистология | Иммунологические маркеры | |
| Лимфома Ходжкина | Часто без патологии | Клетки Штернберга | CD15, CD30 |
| Реактивный лимфаденит | Умеренный лейкоцитоз, ускорение СОЭ | Иммунобласты | - |
| Неходжкинская лимфома | Часто без патологии, в некоторых случаях – ускорение СОЭ | Варианты НХЛ | В или Т-клеточный иммунофенотип соответственно морфологическому варианту НХЛ |
| Хр. лимфолейкоз | Лейкоцитоз с абсолютным лимфоцитозом | Малые лимфоциты | CD19, CD20, CD22 |
| Метастазы солидных опухолей | Часто без патологии, в некоторых случаях – ускорение СОЭ | Вариант опухоли | - |
| Саркоидоз Бенье-Бека | Часто без патологии, в некоторых случаях – ускорение СОЭ | Клетки Пирогова-Лангханса | |
| ВИЧ | AIDS | ||
| Туберкулезный лимфаденит | Лейкопения, лимфоцитоз, ускорение СОЭ | Клетки Пирогова-Лангханса | |
| Саркома Капоши | Часто без патологии, в некоторых случаях – ускорение СОЭ | Человеческий вирус герпеса 8-го типа | |
Лечение
Стандартной схемой химиотерапии для лечения больных благоприятной и промежуточной прогностической группы в настоящее время является схема ABVD. Эта схема более эффективна и менее токсична, чем МОРР и ее варианты (COPP, CVPP, LVPP) , однако последние 3 схемы остаются схемами первой линии терапии. Для лечения больных неблагоприятной прогностической группы предпочтительной является схема BEACOPP.
I линия
Лечение поздних рецидивов основано на тех же принципах, что и терапия первичных больных. При рецидивах, возникших через 5-7 лет полной ремиссии необходимо проводить повторную биопсию с целью исключения опухоли другого генеза. Достижение ремиссии возможно по схемам, использованным при индукции первой ремиссии, или при применении других схем первой линии.
II линия – лечение рецидивов
Определение.Лимфомы это гетерогенная группа опухолей иммунной системы внекостномозгового происхождения, субстратом которых являются лимфоидные клетки. Существует несколько разновидностей классификации лимфом.
Классификация лимфом (упрощённый вариант)
По степени злокачественности:
По характеру пролиферации в лимфатическом узле:
По величине опухолевых клеток:
Классификация лимфом по стадиям
(Ray, 1965 г., Аn Аrbor, 1971 г., Cotswald, 1989 г.)
Стадия I − поражение одного лимфатического региона (лимфоузлы шеи, подмышечные, паховые, средостения, ворот легких справа и слева) (I, N) или структуры (вилочковой железы, кольца Вальдейера, червеобразного отростка слепой кишки, Пейеровых бляшек) или локализованное поражение одного экстралимфатического органа или ткани в пределах одного сегмента (IЕ). Локализованное поражение экстралимфатической ткани определяется как прорастание пораженного лимфоузла или ткани в анатомической близости от него, которое может быть излечено облучением.
Стадия II − поражение двух или более лимфатических регионов по одну сторону диафрагмы либо локализованное поражение одного экстралимфатического органа или ткани и их регионарных лимфатических узлов с (или без) поражения лимфатических регионов по ту же сторону диафрагмы (IIE). Указывается число пораженных лимфатических регионов (II2).
Стадия III − поражение лимфатических регионов или структур по обе стороны диафрагмы, которое может сочетаться с локализованным поражением одного экстралимфатического органа или ткани (IIIE) либо с поражением селезенки (IIIS) или поражением того и другого (III E+S). Выделяют: верхние абдоминальные лимфатические узлы: ворота печени, селезенки, чревные (III1), нижние абдоминальные: парааортальные, мезентериальные (III2).
Стадия IV – диссеминированное поражение одного или нескольких экстралимфатических органов, с поражением лимфатических узлов или без него, либо изолированное поражение экстралимфатического органа с поражением отдаленных (не регионарных) лимфатических узлов.
Локальное поражение обозначается символом: N – лимфоузлы, L – легкие, D – кожа, Н – печень, М – костный мозг, О – кости, Р – плевра, S – селезенка.
Признаки опухолевой интоксикации при лимфомах: А – отсутствие симптомов интоксикации, В – наличие хотя бы одного из следующих симптомов: температура тела выше 38ºС не менее 3 дней подряд без признаков воспалительного процесса, ночная потливость, снижения массы тела на 10% и более за 6 месяцев.
Классические варианты болезни Ходжкина:
– нодулярный склероз (градации 1 и 2)
– классическая лимфома Ходжкина с большим количеством лимфоцитов
Клиническая классификация стадий
I стадия - локализованная - поражены 1-2 группы, расположенных рядом, лимфоузлов.
II стадия - регионарная - поражены 2-3 несмежные группы лимфоузлов, но по одну сторону диафрагмы.
III стадия - генерализованная - поражение групп лимфоузлов по обе стороны от диафрагмы, селезенки.
IV стадия - диссеминированная - помимо лимфоузлов поражены внутренние органы - печень, легкие, плевра и т.д.
Каждая стадия подразделяется на две подгруппы:
А - отсутствие симптомов биологической активности.
Б - имеются признаки биологической активности – лихорадка, кожный зуд, ночные поты, похудание, лейкоцитоз, измененные острофазовые реакции.
Клиническая классификация плазмоклеточной миеломы (ПМ)
по активности течения заболевания
1. Индолентная ПМ – пациенты с дремлющим течением.
2. Активна ПМ – пациенты в ремиссии или состоянии плато после первой линии химиотерапии.
3. Агрессивная ПМ – пациенты с резистентностью к химиотерапии.
Стадии хронического лимфолейкоза
Стадия А –анемия и тромбоцитопения отсутствуют, процесс захватывает менее трёх зон.
Стадия В– анемия и тромбоцитемия отсутствуют (гемоглобин и количество тромбоцитов равно или более 100 ед.), процесс распространяется на три и более зоны.
Стадия С– имеется анемия и тромбоцитопения независимо от распространённости процесса.
Таким образом, среди онкогематологических заболеваний выделяют лейкозы и лимфомы. Лейкозы – это опухолевые заболевания кроветворной системы, при которых первичной локализацией опухолевого процесса является костный мозг. Лимфомы – это опухоль с первичным расположением вне костного мозга. Классификации онкогематологических заболеваний постоянно совершенствуются.
Лейкозу, как патологическому процессу, свойственны особенности, присущие и другим опухолям, в частности неуправляемая клеточная гиперплазия пораженного ростка кроветворной ткани. При этом разрастание опухолевых клеток происходит не только в местах нормального кроветворения, но и в жировом, обычно неактивном, костном мозге трубчатых костей и экстрамедуллярных очагах кроветворения (селезенке, лимфатических узлах, в скоплениях лимфоидной ткани и других органах). Течение патологического процесса сопровождается выходом опухолевых клеток в кровеносное русло. Все лейкозы обозначаются в соответствии с названием клеток, отражающих их цитоморфологическую сущность.
В основе деления лейкозов на острые и хронические лежит морфологическая характеристика опухолевых клеток.
Основной субстрат опухолевого заболевания системы крови при остром лейкозе – бластные клетки, при хроническом лейкозе – созревающие и зрелые клетки (п/я и с/я гранулоциты при хроническом миелолейкозе, лимфоциты при хроническом лимфолейкозе и т.д.).
Клиническая картина, течение и длительность заболевания не являются определяющими в делении лейкозов на острые и хронические.
Примеры формулировки диагноза
1. Острый промиелоцитарный лейкоз, развёрнутая стадия.
2. Хронический миелолейкоз (Ph-позитивный или Ph-негативный). Хроническая стадия или стадия акселерации; анемия, тромбоцитопения и т.д.
3. В-клеточный острый лимфоцитарный лейкоз, дебют заболевания.
4. Лимфогранулематоз (болезнь Ходжкина), III стадия, фаза Б.
5. Хронический лимфолейкоз, 2стадия.
Диагностика гемобластозов основана на поэтапном применении комплекса клинических, лабораторных и инструментальных исследований. На первом этапе предполагается гемобластоз. По данным исследования периферической крови, цитологического и гистологического методов определяют миелоидный или лимфоидный опухолевый процесс, острый или хронический его характер. В завершении диагностического поиска на основании цитохимических, иммунологических, цитогенетических, молекулярногенетических, иммуногистохимических исследований определяют конкретную нозологическую форму гемобластоза. Верификация диагноза онкогематологического заболевания осуществляется в специализированных медицинских отделениях. Объём дополнительных исследований зависит от их возможностей и формы предпологаемого гемобластоза. Для определения распространённости опухолевого процесса применяют КТ, МРТ, ПЭТ. УЗИ и др. методы.
Лечение гемобластозов проводится в специализированных отделениях. Оно включает применение цитостатических средств, нередко миелотрансплантацию, проведение симптоматической терапии. В целях последней может проводиться дезинтоксикационная терапия, применятся антибиотики, средства, улучшающие реологические свойства крови или наоборот гемостатические, могут использоваться препараты крови. При эритремии, наоборот, может проводиться гемоэксфузия. Цитостатики применяют чаще всего в виде полихимиотерапии (2-3 препарата одновременно) с добавлением преднизолона. В лечении каждой формы гемобластоза в специализированных отделениях используют конкретные схемы (протоколы) цитостатической терапии. При этом нередко в них включают препараты ещё не представленные в общероссийских стандартах лечебной помощи.
В настоящее время основным принципом терапии острых лейкозов и лимфом является, по возможности, достижение их радикального лечения. Для этого используют полихимиотерапию, миелотрансплантацию и лучевую терапию. Конкретные методы при лимфомах зависят от гистологического варианта опухоли, степени ее злокачественности, распространенности процесса. Не исключаются также в отдельных случаях хирургические методы. При хронических лейкозах терапия успешна в случаях достижения гематологической и цитогенетической ремиссии.
При отдельных опухолевых заболеваниях системы крови и кроветворных органов, в начальной их стадии от применения цитостатических средств, преднизолона целисообразно воздерживаться. Решение об этом должен принимать гематолог. Дозируют многие цитостатики применительно к массе или площади поверхности тела.
Этапы лечения острого лейкоза
1. Индукция ремиссии.
2. Постремиссионная терапия.
3. Консолидация ремиссии или интенсификация. Профилактика нейролейкоза.
4. Поддерживающая терапия в ремиссии. Лечение резидуальной болезни.
Основные лечебные средства,
используемые при лечении острого лейкоза
1. Антиметаболиты: цитарабин, метотрексат, меркаптопурин, тиогуанин.
2. Алкалоиды: винкристин, тенипозид, этопозид.
3. Антибиотики цитостатические: даунорубицин, доксорубицин, идарубицин, метоксантрон.
4. Алкилирующие препараты: циклофосфамид.
5. Другие противоопухолевые препараты: L-аспарагиназа.
Основные цитостатические средства, используемые при лечении наиболее распространённых хронических онкогематологических заболеваний: хронического миелоза (ХМЛ), истинной полицитемии (ИП), хронического лимфолейкоза (ХЛЛ), множественной миеломы (ММ), лимфогранулематоза (ЛГМ) и неходжкинских лимфом (НХЛ) представлены в таблице.
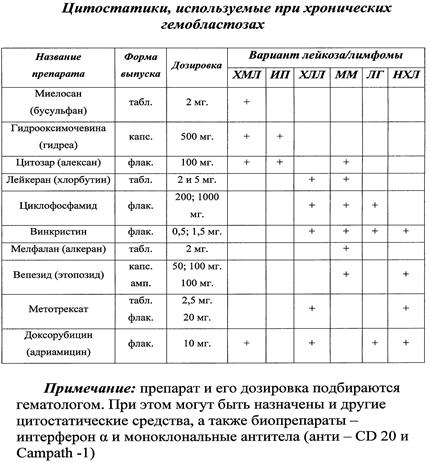
В амбулаторной практике при лечении хронического миелоза в основном используются следующие цитостатики: миелосан, бусульфан – 4-6 мг/сут., миелобромол – 250 мг/сут., гидрооксимочевина (гидреа) – 500 мг/сут., гливек – 400-600 мг/сут.
При лечении больных хроническим лимфолейкозом – хлорбутин 0,1-0,2 мг/кг массы тела. Можно присоединять другие цитостатики, преднизолон. Частота применения и дозировка зависят от показателей гемограмы.
Лимфома Ходжкина
В обзорной клинической статье приводятся сведения о патогенезе, диагностике и лечении лимфомы Ходжкина, рассматриваются вопросы ранней диагностики, подчеркивается роль раннего морфологического исследования, лучевых методов диагностики, необходимость создания семенного фонда у молодых мужчин перед началом химиотерапии, важность строгого соблюдения стадирования, уточнения факторов прогноза, неукоснительного соблюдения программ терапии.
Лимфома Ходжкина (болезнь Ходжкина, лимфогранулематоз) – группа заболеваний лимфоидной ткани, включающая как минимум классическую лимфому Ходжкина и нодулярный тип лимфоидного преобладания. Классическая лимфома Ходжкина (ЛХ) – моноклональная опухоль, субстратом которой являются клетки Березовского-Рид-Штернберга (БРШ) и Ходжкина, которые происходят из В-клеток герминального центра фолликула. Они составляют около 1% от массы всей опухолевой ткани, состоящей из реактивных, неопухолевых Т- и В-лимфоцитов с примесью гранулоцитов и макрофагов.
В РФ общее количество впервые заболевших лимфогранулематозом составляет около 3,5 тыс. человек в год. Выявляются 2 основных пика заболеваемости ЛХ: первый приходится на 15–35 лет, второй наблюдается после 60 лет; соотношение мужчины/женщины примерно равное. В средней полосе России заболеваемость ЛХ составляет около 2,5 на 100 тыс. человек за год. В Москве и Московской области с численностью около 20 млн человек число заболевших может составить около 500 человек в год.
Этиология заболевания не известна. Пристально изучается роль вируса Эпштейна-Барр в возникновении заболевания.
В патогенезе ЛХ рассматриваются следующие проблемы. Морфологическим субстратом болезни является небольшое количество опухолевых клеток в массе опухоли, которая в основном состоит из реактивных Т-клеток, в частности CD4+. Цитокины, выделяемые этими клетками в ответ на опухоль, определяют клинические В-симптомы болезни, а также структуру опухоли, инвазирующей соседние ткани.
С.М. Алещенко с соавт. выделили группы генов, сцепленные с плохим прогнозом – резистентностью к терапии и рецидивирующим на фоне полихимиотерапии (ПХТ) течением.
В целом патогенез ЛХ может рассматриваться как ряд последовательных событий: больной ЛХ получает по одному неблагоприятному признаку вероятности развития ЛХ от каждого из родителей, став гомозиготой по этому признаку. Родители больного ЛХ передают HLA-DR признак, который выявляется определенным набором HLA-DR маркеров. Гены системы HLA-DR локализованы на коротком плече 6-й хромосомы.
По данным Алещенко, у части больных ЛХ выявлены генетические маркеры. Она исследовала 112 больных ЛХ, наблюдавшихся в отделении химиотерапии гематологических заболеваний и интенсивной терапии (ГИИТ) ГНЦ РАМН с 1996 по 2000 г. Изучены образцы геномной ДНК из лимфоцитов периферической крови. Показано, что существует положительная ассоциация между развитием ЛХ и наличием генов Cw7 и DRB1*11. Для носителей специфичности DRB1*07 выявлена значимая отрицательная ассоциация с восприимчивостью к ЛХ. Выявлено снижение риска развития ЛХ в молодом возрасте для лиц, имеющих в HLА-генотипе специфичность DRB1*01. Установлено повышение частоты общих НLA-специфичностей 1-го класса у родительских пар, имеющих больного ребенка. Значение данного показателя составляет соответственно 100% против 60%. Ген DRB1*04 ассоциирован у больных ЛХ с достижением полной ремиссии – частота DRВ1*04 в группе пациентов в ремиссии 5 и более лет (20%) выше частоты данной специфичности в группе больных, рефрактерных к ПХТ первой линии (8%) [1]. У пациентов с факторами риска по системе немецких авторов Хасанклевера и Уолкера Диля, основанной на наблюдении почти 6 тыс. больных ЛХ (мужской пол, возраст старше 45 лет, IV стадия заболевания, уровень гемоглобина менее 105 г/л, лейкоцитоз более 16х10/*9, лимфопения
Представляет интерес изучение полиморфизма генов, ответственных за метаболизм цитостатических препаратов, т. к. в ряде случаев при малой активности соответствующих ферментов мы не получаем противоопухолевого эффекта, при повышенной активности ферментов наблюдаются проявления избыточной токсичности. Возможно, полиморфизм генов системы HLA-DR и генетические механизмы лекарственной резистентности взаимосвязаны.
При изучении изолированных клеток БРШ выявлены глобальные механизмы, которые подавляют специфическую экспрессию генов В-клеток. Показано нарушение активности рецептора тирозинкиназы в клетках БРШ при классическом варианте ЛХ и в меньшей степени при варианте лимфоцитарного преобладания. Эта находка является уникальной для ЛХ и может способствовать более успешной химиотерапии [2].
Наши наблюдения за больными ЛХ с ВИЧ-инфекцией выявляют очень интересную проблему. При рассмотрении кривых заболеваемости ВИЧ-инфицированных больных разными болезнями в течение 15 лет до начала высокоактивной антиретровирусной терапии (ВААРТ) (1981–1996 гг.) и в течение такого же времени после введения ВААРТ (1996 – по настоящее время) оказалось, что в левой части графика заболеваемость злокачественными лимфомами, включая первичную лимфому ЦНС и саркому Капоши, возросла в сравнении с неинфицированной популяцией в 168 раз! Заболеваемость ЛХ и солидными опухолями до начала ВААРТ не отличалась от таковой в здоровой популяции (2,5 на 100 тыс. населения). Напротив, в правой половине графика (т. е. после начала ВААРТ) кривые первых двух болезней резко снизились, первичная лимфома ЦНС и саркома Капоши стали встречаться очень редко. Заболеваемость солидными опухолями не изменилась. Интересным фактом стало увеличение заболеваемости ЛХ до 8 раз с началом приема ВААРТ! Это означает, что для реализации ЛХ как болезни необходимо как минимум присутствие CD4+-лимфоцитов. Продолжение наблюдения за больными ЛХ с ВИЧ-инфекцией показало, что ЛХ у этой группы пациентов излечивается лучше, чем у неинфицированных больных: быстрый регресс симптомов, возможность достичь излечения при грубых нарушениях протокола лечения по времени (чрезмерно затянутые интервалы между курсами ПХТ). Эти два факта, полученные при непосредственном наблюдении и лечении больных ЛХ с ВИЧ-инфекцией, нуждаются в научном объяснении, которого пока нет.
Известен воспалительный синдром иммунологического восстановления у ВИЧ-инфицированных больных (Immune Reconstitution Inflammatory Syndrome – IRIS) –появление новых или обострение ранее пролеченных инфекционных или неинфекционных заболеваний на фоне положительного иммунологического и вирусологического ответа на ВААРТ. Он изучен при туберкулезе и грибковых инфекциях у ВИЧ-инфицированных больных. Оказалось, что при сочетании туберкулеза и ВИЧ-инфекции начало ВААРТ с повышением CD4+ клеток приводит к резкому ухудшению течения туберкулеза, и, напротив, первоначальная терапия туберкулеза с последующим присоединением ВААРТ не сопровождается развитием IRIS. CD4+ клетки необходимы для реализации туберкулезного процесса. Аналогичную картину мы наблюдаем при росте заболеваемости ЛХ в начале ВААРТ. Рассмотрение этого феномена в рамках IRIS заслуживает внимательного изучения. Если при туберкулезе в случае IRIS этиологическим фактором являются микобактерии, то при ЛХ одним из этиологических факторов может быть вирус Эпштейна-Барр.
Ранее в комплексе работ акад. В.Т. Иванова с соавт., А.А. Карелина с соавт. [3, 4] показано, что короткие пептиды обладают действием нейропептидов, обусловливая, в частности, гибернацию некоторых животных (медведей). Поводом для этих экспериментов явились клинические наблюдения врачей-гематологов за проявлением высшей нервной деятельности у пациентов, страдающих ЛХ. А.В. Пивник с соавт. [5] отметил своеобразные черты личности и характера этих пациентов: эмоциональная холодность, упрямство, скрытность. Отмечено, что характерологические особенности больных ЛХ ярко проявляются у матерей заболевших. До трети пациентов ЛХ категорически отказываются от рекомендованной полихимио- и лучевой терапии, что ведет к гибели больных в течение ближайших лет.
В результате обсуждений этих психологических особенностей пациентов с ЛХ с психологами и психиатрами было сделано заключение, что для больных ЛХ характерна особенность, отмеченная ранее у пациентов со злокачественными опухолями, а именно инфантильность – отказ согласиться с существованием болезни.
Психиатрами отмечены пограничные состояния и достоверное увеличение числа истинной шизофрении среди пациентов с ЛХ.
Таким образом, накапливается все больше данных об этиотропном действии вируса Эпштейна-Барр у субъекта с широким фоном разнообразных событий, таких как наличие сцепленных с плохим прогнозом генов системы HLA, наличие коротких пептидов, факты их онкогенного действия (О.Н. Блищенко с соавт.), наличие достаточного количества CD4+ Т-лимфоцитов [6, 7].
Морфологические варианты ЛХ
Выделяют следующие морфологические варианты лимфо¬гранулемато¬за (классификация ВОЗ, 2008 г.):
Лимфома Ходжкина, нодулярный тип лимфоидного преобладания.
Классическая лимфома Ходжкина:
• классическая лимфома Ходжкина, лимфоидное преобладание (С81.0 по МКБ);
• классическая лимфома Ходжкина, нодулярный склероз (С81.1);
• классическая лимфома Ходжкина, смешанно-клеточная (С81.2);
• классическая лимфома Ходжкина, лимфоидное истощение (С81.3).
При диагностике обычно биопсии подвергается один из увеличенных периферических лимфоузлов. В случае увеличения только внутригрудных или абдоминальных лимфоузлов или селезенки производится диагностическая торакотомия и лапаротомия или спленэктомия.
При первичном осмотре отсутствие общих симптомов (т. н. В-симптомы активности заболевания) определяется как А-стадия заболевания.
Увеличение лимфоузлов относится к местным симптомам ЛХ, чаще всего это периферические лимфоузлы выше диафрагмы (подчелюстные, шейные, надключичные, подмышечные, лимфоузлы средостения). Выявление увеличенных лимфоузлов в нетипичных местах – по ходу нервно-сосудистого пучка плеча, в кубитальной ямке, в поясничной области или экстранодальной локализации (молочная железа, мягкие ткани) – всегда свидетельствует о запущенной стадии ЛХ и неблагоприятном прогнозе. В этих случаях проводится дифференциальная диагностика между неопухолевым и опухолевым поражением лимфоузлов. Поражения ЦНС крайне редки, мы наблюдали одну пожилую больную ЛХ с общемозговой симптоматикой и объемным поражением мозга, доказанным с помощью МРТ. Обязательно исключается диагноз боковой кисты шеи, нередко симулирующей ЛХ. Увеличение размеров селезенки обычно выявляется при первичном осмотре, она плотная, гладкая, пальпируется ниже края реберной дуги на несколько сантиметров. Иногда спленомегалия может быть массивной, достигая массы 1 кг и более. Чаще небольшая спленомегалия выявляется при УЗИ живота, превышая нормальные размеры 11х4 см. Значительное увеличение размеров печени подтверждает IV стадию заболевания, которая выявляется нечасто. При ЛХ отмечается появление В-симптомов: лихорадка 38 °С в течение нескольких недель, профузная потливость с необходимостью смены постельного белья, потеря веса на 10% за последние 6 месяцев. Кожный зуд исключен из этих признаков, однако он является прогностическим признаком, который, так же как и гиперэозинофилия, превышающая 10–15% в общем анализе крови, определяет эффект терапии и возникновение рецидивов.
Дифференциальный диагноз проводится с метастазами рака, опухолями головы и шеи, включая назофарингеальную карциному, опухоль Шнитке, опухоли щитовидной железы, опухоли слюнных желез, а также опухолями других локализаций – молочной железы, ЖКТ, гениталий, внегонадными герминогенными опухолями. К неопухолевым заболеваниям относятся: вирусные лимфаденопатии, в первую очередь инфекционный мононуклеоз, в этих случаях не следует торопиться с биопсией лимфоузла, наблюдая за больным несколько недель. Также нельзя забывать о бактериальных лимфаденитах, обычно одонтогенного происхождения. В этих случаях следует назначить пациенту санацию полости рта, лечение антибиотиками и понаблюдать больного в течение нескольких недель. Все чаще при биопсии шейных и надключичных лимфоузлов наблюдается туберкулезное поражение. Мы наблюдали больных с шейной лимфаденопатией при локализации сифилитического шанкра на миндалине и губе. Нам приходилось за 1 неделю работы получать заключения по биопсии лимфоузлов этой области с диагнозами: беспигментная меланома, саркома Капоши, болезнь Гоше, туберкулезный лимфаденит.
Диагноз ЛХ всегда ставится морфологически – по результатам биопсии лимфоузла, селезенки или другой пораженной ткани. Исследование включает описание гистологических срезов, окрашенных гематоксилин-эозином, при световой микроскопии. Недопустимым является предположительный диагноз по цитологическому анализу тонкоигольной пункционной биопсии, полученной при пункции лимфоузла.
Морфологи ввели новые методы исследования, без которых современный диагноз лимфомы, ЛХ был нередко недостижим. Были введены анти-CD-антитела – иммунные маркеры, прицельно высвечивающие характерные для каждого варианта лимфом клетки. Молекулярно-биологические методы с использованием единичной изолированной опухолевой клетки позволяют изучать в деталях геном опухолевой клетки. Именно комплексные исследования (световое микроскопическое, иммуногистохимическое, молекулярно-биологическое) позволяют сделать патологоанатомическое заключение по поводу конкретного больного [8]. Результаты этих методов исследований, проведенных у нескольких тысяч больных лимфомами, легли в основу классификации злокачественных заболеваний кроветворной и лимфоидной ткани, предложенной ВОЗ в 2008 г.
После завершения этих исследований проводится стадирование с определением объема поражения лимфатической ткани, т. е. устанавливается стадия ЛХ.
Классификация по стадиям ( Ann . Arbor , 1971, с дополнением в Costwolds , 1989)
Поражение одной лимфатической зоны или одного лимфоидного органа (селезенка, тимус, Вальдейрово кольцо) или одного нелимфоидного органа
Поражение 2 и более лимфатических зон с одной стороны диафрагмы (поражение воротных лимфоузлов с обеих сторон диафрагмы относят ко II стадии); локализованное поражение только одного нелимфоидного органа или ткани (например, стенки грудной клетки) по протяжению с одной стороны диафрагмы (IIE). Число пораженных анатомических зон указывается арабской цифрой, нижним индексом (II 3 )
Поражение лимфатических зон с обеих сторон диафрагмы (III), которое может сопровождаться поражением селезенки (III S ) или локальным поражением по протяжению только одного нелимфоидного органа/ткани или и того и другого (IIISE).
III 1 с поражением селезеночных, воротных или портальных лимфоузлов либо без него
III 2 с поражением парааортальных, подвздошных и мезентериальных лимфоузлов
Диффузное или диссеминированное поражение нелимфоидного органа (или ткани) с поражением лимфоузлов или без него
Дополнительные обозначения, указываемые с любой стадией
Читайте также:

