Как определить степень окисления в соединениях с хлором

Что такое степень окисления
Условный заряд атомов элементов в сложных веществах называется степенью окисления. Значение заряда атомов записывается в окислительно-восстановительных реакциях, чтобы понять, какой элемент является восстановителем, а какой – окислителем.
Степень окисления взаимосвязана с электроотрицательностью, которая показывает возможность атомов принимать или отдавать электроны. Чем выше значение электроотрицательности, тем больше способность атома отнимать электроны в реакциях.

Рис. 1. Ряд электроотрицательности.
Степень окисления может иметь три значения:
- нулевое – атом находится в состоянии покоя (все простые вещества имеют степень окисления 0);
- положительное – атом отдаёт электроны и является восстановителем (все металлы, некоторые неметаллы);
- отрицательное – атом принимает электроны и является окислителем (большинство неметаллов).
Например, степени окисления в реакции натрия с хлором выглядят следующим образом:
В реакции металлов с неметаллами металл всегда является восстановителем, а неметалл – окислителем.
Как определить
Существует таблица, в которой указаны все возможные степени окисления элементов.
Название
Символ
Степень окисления
-3, -2, -1, 0, +1, +2, +3, +4, +5
1, 0, +1, +3, +5, +7, редко +2 и +4
+2, +3, редко +4 и +6
-1, +1, +5, редко +3, +4
+3, +6, редко +2, +3, +5
+3, +4, +8, редко +2, +6, +7
-1, +1, +5, +7, редко +3, +4
+6, редко +2, +3, +4, +5
+2, +4, +6, +7, редко -1, +1, +3, +5
+3, +4, +6, +8, редко +2
+3, +4, +6, редко +1, +2
+2, +4, +6, редко +1, +3
+3, редко +3, +2, +4, +5
Или использовать на уроках этот вариант таблицы.

Рис. 2. Таблица степеней окисления.
Кроме того, степени окисления химических элементов можно определить по периодической таблице Менделеева:
- высшая степень (максимально положительная) совпадает с номером группы;
- для определения минимального значения степени окисления из номера группы вычитается восемь.

Рис. 3. Таблица Менделеева.
Большинство неметаллов имеют положительную и отрицательную степени окисления. Например, кремний находится в IV группе, значит, его максимальная степень окисления +4, а минимальная -4. В соединениях неметаллов (SO3, CO2, SiC) окислителем является неметалл с отрицательной степенью окисления или с большим значением электроотрицательности. Например, в соединении PCl3 фосфор имеет степень окисления +3, хлор -1. Электроотрицательность фосфора – 2,19, хлора – 3,16.
Второе правило не работает для щелочных и щелочноземельных металлов, которые всегда имеют одну положительную степень окисления, равную номеру группы. Исключения составляют магний и бериллий (+1, +2). Также постоянную степень окисления имеют:
- алюминий (+3);
- цинк (+2);
- кадмий (+2).
Остальные металлы имеют непостоянную степень окисления. В большинстве реакций выступают в качестве восстановителя. В редких случаях могут быть окислителями с отрицательной степенью окисления.
Фтор – самый мощный окислитель. Его степень окисления всегда -1.
Что мы узнали?
Из урока 8 класса узнали о степени окисления. Это условная величина, показывающая, сколько электронов может отдать или принять атом в ходе химической реакции. Значение связано с электроотрицательностью. Окислители принимают электроны и имеют отрицательную степень окисления, восстановители отдают электроны и проявляют положительную степень окисления. Большинство металлов – восстановители с постоянной или переменной степенью окисления. Неметаллы могут проявлять свойства окислителя и восстановителя в зависимости от вещества, с которым реагируют.
Валентность (лат. valere - иметь значение) - мера "соединительной способности" химического элемента, равная числу индивидуальных химических связей, которые может образовать один атом.
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим молекулу
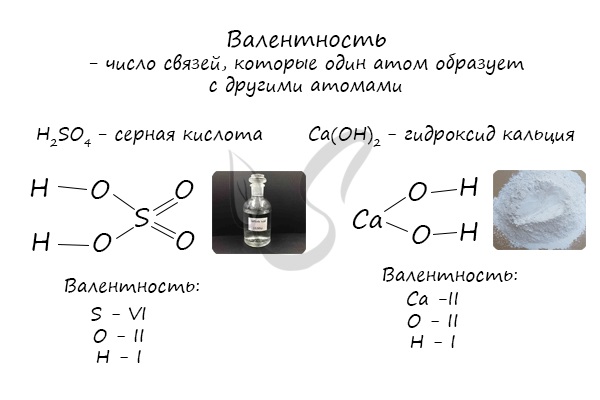
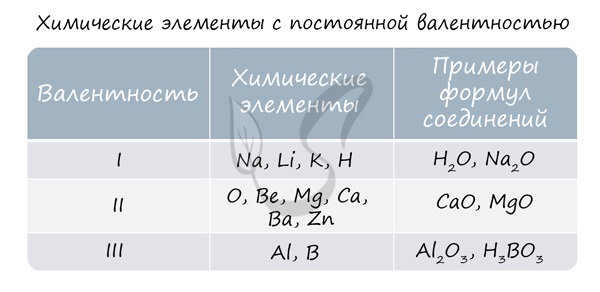
Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.
В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для полного понимания.
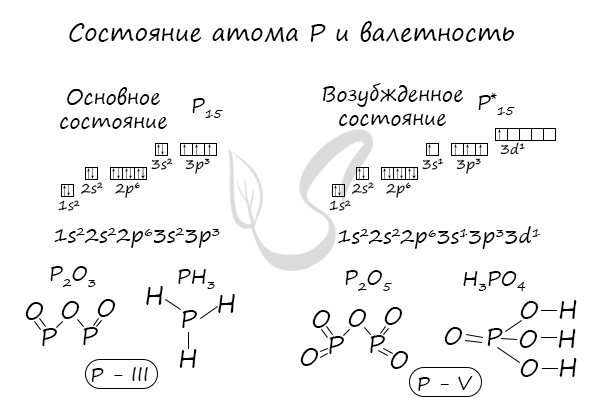
Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди, железа, фосфора, хрома, серы.
Ниже вы увидите элементы с переменной валентностью и их соединения. Заметьте, определить их непостоянную валентность нам помогают другие элементы - с постоянной валентностью.

Запомните, что у некоторых простых веществ валентность принимает значения: III - у азота, II - кислорода. Подведем итог полученным знаниям, написав графические формулы азота, кислорода, углекислого и угарного газов, карбоната натрия, фосфата лития, сульфата железа (II) и ацетата калия.

Как вы заметили, валентности обозначаются римскими цифрами: I, II, III и т.д. На представленных формулах валентности веществ равны:
- N - III
- O - II
- H, Na, K, li - I
- S - VI
- C - II (в угарном газе CO), IV (в углекислом газе CO2 и карбонате натрия Na2CO3
- Fe - II
Степенью окисления (СО) называют условный показатель, который характеризует заряд атома в соединении и его поведение в ОВР (окислительно-восстановительной реакции). В простых веществах СО всегда равна нулю, в сложных - ее определяют исходя из постоянных степеней окисления у некоторых элементов.
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны, образующие связи, перешли к более электроотрицательному элементу.
Определяя степень окисления, одним элементам мы приписываем условный заряд "+", а другим "-". Это связано с электроотрицательностью - способностью атома притягивать к себе электроны. Знак "+" означает недостаток электронов, а "-" - их избыток. Повторюсь, СО - условное понятие.
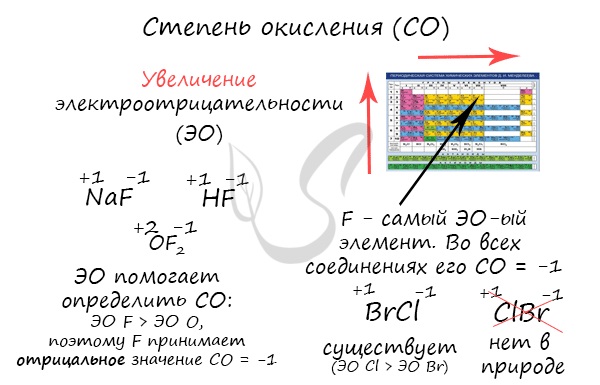
Сумма всех степеней окисления в молекуле равна нулю - это важно помнить для самопроверки.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент принимает "+", а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Кто более электроотрицательный, тот сильнее притягивает к себе электроны и "уходит в минус". Кто отдает свои электроны и испытывает их недостаток - получает знак "+".

Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2, KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией :) Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию ;-)

Особо хочу выделить тему ионов. Ион - атом, или группа атомов, которые за счет потери или приобретения одного или нескольких электронов приобрел(и) положительный или отрицательный заряд.
Определяя СО атомов в ионе, не следует стремиться привести общий заряд иона к "0", как в молекуле. Ионы даны в таблице растворимости, они имеют разные заряды - к такому заряду и нужно в сумме привести ион. Объясню на примере.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Хлор в таблице менделеева занимает 17 место, в 3 периоде.
| Символ | Cl |
| Номер | 17 |
| Атомный вес | 35.4460000 |
| Латинское название | Chlorum |
| Русское название | Хлор |
Электронная схема хлора
Cl: 1s 2 2s 2 2p 6 3s 2 3p 5
Короткая запись:
Cl: [Ne]3s 2 3p 5
Одинаковую электронную конфигурацию имеют атом хлора и P -2 , S -1
Порядок заполнения оболочек атома хлора (Cl) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ - до 6, на ‘d’ - до 10 и на ‘f’ до 14
Хлор имеет 17 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
5 электронов на 3p-подуровне
Степень окисления хлора
Атомы хлора в соединениях имеют степени окисления 6, 5, 4, 3, 2, 1, 0, -1, -2.
Степень окисления - это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы хлора
Валентность Cl
Атомы хлора в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность хлора характеризует способность атома Cl к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Cl
Квантовые числа определяются последним электроном в конфигурации, для атома Cl эти числа имеют значение N = 3, L = 1, Ml = 0, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат: 
Энергия ионизации
Чем ближе электрон к центру атома - тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации - это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Степени окисления элементов. Как найти степени окисления?
Чтобы правильно расставлять степени окисления , необходимо держать в голове четыре правила.
1) В простом веществе степень окисления любого элемента равна 0. Примеры: Na 0 , H 0 2 , P 0 4 .
2) Следует запомнить элементы, для которых характерны постоянные степени окисления . Все они перечислены в таблице.
| Элемент | Характерная степень окисления | Исключения |
| H | +1 | Гидриды металлов: LIH -1 |
| F | -1 | F 2 |
| O | -2 | F 2 O +2 ; пероксиды, надпероксиды, озониды |
| Li, Na, K, Rb, Cs, Fr | +1 | |
| Be, Mg, Ca, Sr, Ba, Ra | +2 | |
| Al | +3 |
3) Высшая степень окисления элемента, как правило, совпадает с номером группы, в которой находится данный элемент (например, фосфор находится в V группе, высшая с. о. фосфора равна +5). Важные исключения: F, O.
4) Поиск степеней окисления остальных элементов основан на простом правиле:
Несколько простых примеров на определение степеней окисления
Пример 1 . Необходимо найти степени окисления элементов в аммиаке (NH 3 ).
Решение . Мы уже знаем (см. 2), что ст. ок. водорода равна +1. Осталось найти эту характеристику для азота. Пусть х - искомая степень окисления. Составляем простейшее уравнение: х + 3 • (+1) = 0. Решение очевидно: х = -3. Ответ: N -3 H 3 +1 .
Пример 2 . Укажите степени окисления всех атомов в молекуле H 2 SO 4 .
Решение . Степени окисления водорода и кислорода уже известны: H(+1) и O(-2). Составляем уравнение для определения степени окисления серы: 2 • (+1) + х + 4 • (-2) = 0. Решая данное уравнение, находим: х = +6. Ответ: H +1 2 S +6 O -2 4 .
Пример 3 . Рассчитайте степени окисления всех элементов в молекуле Al(NO 3 ) 3 .
Решение . Алгоритм остается неизменным. В состав "молекулы" нитрата алюминия входит один атом Al(+3), 9 атомов кислорода (-2) и 3 атома азота, степень окисления которого нам и предстоит вычислить. Соответствующее уравнение: 1 • (+3) + 3х + 9 • (-2) = 0. Ответ: Al +3 (N +5 O -2 3 ) 3 .
Пример 4 . Определите степени окисления всех атомов в ионе (AsO 4 ) 3- .
Решение . В данном случае сумма степеней окисления будет равна уже не нулю, а заряду иона, т. е., -3. Уравнение: х + 4 • (-2) = -3. Ответ: As(+5), O(-2).
Что делать, если неизвестны степени окисления двух элементов
А можно ли определить степени окисления сразу нескольких элементов, пользуясь похожим уравнением? Если рассматривать данную задачу с точки зрения математики, ответ будет отрицательным. Линейное уравнение с двумя переменными не может иметь однозначного решения. Но ведь мы решаем не просто уравнение!
Пример 5 . Определите степени окисления всех элементов в (NH 4 ) 2 SO 4 .
Решение . Степени окисления водорода и кислорода известны, серы и азота - нет. Классический пример задачи с двумя неизвестными! Будем рассматривать сульфат аммония не как единую "молекулу", а как объединение двух ионов: NH 4 + и SO 4 2- . Заряды ионов нам известны, в каждом из них содержится лишь один атом с неизвестной степенью окисления. Пользуясь опытом, приобретенным при решении предыдущих задач, легко находим степени окисления азота и серы. Ответ: (N -3 H 4 +1 ) 2 S +6 O 4 -2 .
Вывод: если в молекуле содержится несколько атомов с неизвестными степенями окисления, попробуйте "разделить" молекулу на несколько частей.
Как расставлять степени окисления в органических соединениях
Пример 6 . Укажите степени окисления всех элементов в CH 3 CH 2 OH.
Решение . Нахождение степеней окисления в органических соединениях имеет свою специфику. В частности, необходимо отдельно находить степени окисления для каждого атома углерода. Рассуждать можно следующим образом. Рассмотрим, например, атом углерода в составе метильной группы. Данный атом С соединен с 3 атомами водорода и соседним атомом углерода. По связи С-Н происходит смещение электронной плотности в сторону атома углерода (т. к. электроотрицательность С превосходит ЭО водорода). Если бы это смещение было полным, атом углерода приобрел бы заряд -3.
Атом С в составе группы -СН 2 ОН связан с двумя атомами водорода (смещение электронной плотности в сторону С), одним атомом кислорода (смещение электронной плотности в сторону О) и одним атомом углерода (можно считать, что смещения эл. плотности в этом случае не происходит). Степень окисления углерода равна -2 +1 +0 = -1.
Ответ: С -3 H +1 3 C -1 H +1 2 O -2 H +1 .
Не смешивайте понятия "валентность" и "степень окисления"!
Степень окисления часто путают с валентностью. Не совершайте подобной ошибки. Перечислю основные отличия:
- степень окисления имеет знак (+ или -), валентность - нет;
- степень окисления может быть равна нулю даже в сложном веществе, равенство валентности нулю означает, как правило, что атом данного элемента не соединен с другими атомами (всякого рода соединения включения и прочую "экзотику" здесь обсуждать не будем);
- степень окисления - формальное понятие, которое приобретает реальный смысл лишь в соединениях с ионными связями, понятие "валентность", наоборот, наиболее удобно применять по отношению к ковалентным соединениям.
Степень окисления (точнее, ее модуль) часто численно равен валентности, но еще чаще эти величины НЕ совпадают. Например, степень окисления углерода в CO 2 равна +4; валентность С также равна IV. А вот в метаноле (CH 3 OH) валентность углерода остается той же, а степень окисления С равна -1.
Небольшой тест на тему "Степень окисления"
Потратьте несколько минут, проверьте, как вы усвоили эту тему. Вам необходимо ответить на пять несложных вопросов. Успехов!
Для желающих еще немного потренироваться рекомендую соответствующий тематический тест.
Свойства простых веществ:
Свойства сложных веществ:
Особенности протекания реакций:
Возможные степени окисления элементов
Перед тем как начать писать окислительно-восстановительные реакции, необходимо знать какие степени окисления может проявлять тот или иной химический элемент. Рассмотрим степени окисления, знание которых необходимо для успешной сдачи ЕГЭ.
| Степень окисления | Элементы | Примеры соединений | Названия соединений |
|---|---|---|---|
| -1 | F | NaF OF2 | Фторид натрия Фторид кислорода |
| +1 | Все металлы 1-ой группы главной подгруппы (Li-Fr) | Na2O KH | Оксид натрия Гирид калия |
| +2 | Все металлы 2-ой группы главной подгруппы (Be-Ra), а также Zn и Cd | BeO CaH2 | Оксид бериллия Гидрид кальция |
| +3 | Al | Al2O3 Al(OH)3 Al2(SO4)3 | Оксид алюминия Гидроксид алюминия Сульфат алюминия |
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | H2 | Водород (простое вещество) | В твердом состоянии, как и все газы, образует молекулярную кристаллическую решетку |
| +1 | H2O H2O2 H2SO4 KOH NaHSO3 | Вода Пероксид водорода Серная кислота Гидроксид калия Гидросульфит натрия | В таких соединениях, как вода, пероксид водорода, все кислоты, основания, кислые соли, все органические соединения |
| -1 | NaH CaH2 | Гидрид натрия Гидрид кальция | Только с металлами водород может проявлять степень окисления -1 |
Положительные степени окисления кислород проявляет только в соединениях с фтором
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | S8 | Сера | Светло-желтый порошок; нерастворим в воде, тяжелее её, но в воде не тонет, плавает на её поверхности, так как ею не смачивается. Молекулы S8 образуют молекулярную кристаллическую решетку. Сера существует в виде нескольких аллотропных модификаций: ромбическая, моноклинная, пластическая. |
| -2 | H2S CaS | Сероводородная кислота Сульфид кальция | Все сульфиды |
| -1 | FeS2 | Персульфид железа (II) (пирит, серный колчедан, железный колчедан) | Единственное соединение со ст. ок. -1 |
| +4 | SO2 H2SO3 CaSO3 | Оксид серы (IV) Сернистая кислота Сульфит кальция | В таких соединениях как оксид серы (IV), сернистой кислоте и всех её солях |
| +6 | SO3 H2SO4 CaSO4 | Оксид серы (VI) Серная кислота Сульфат кальция | В таких соединениях как оксид серы (VI), серной кислоте и всех её солях |
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | N2 | Азот (простое вещество) | В твердом состоянии, как и все газы, образует молекулярную кристаллическую решетку |
| -3 | NH3 Na3N Ca3N2 | Аммиак Нитрид натрия Нитрид кальция | В таких соединениях, как аммиак и все нитриды |
| -2 | N2H4 | Гидразин | Степени окисления -2 и -1 встречаются только в органических соединениях |
| -1 | NH2OH | Гидроксиламин | |
| +1 | N2O | Оксид азота (I) | Азот проявляет положительные степени окисления только в соединениях с кислородом и фтором |
| +2 | NO | Оксид азота (II) | |
| +3 | N2O3 HNO2 NF3 | Оксид азота (III) Азотистая кислота Фторид азота (III) | В таких соединениях, как оксид азота (III), азотистой кислоте и всех её солях, фториде азота (III) |
| +4 | NO2 | Оксид азота (IV) | Смешанный оксид азота (IV) |
| +5 | N2O5 HNO3 | Оксид азота (V) Азотная кислота | В таких соединениях, как оксид азота (V), азотной кислоте и всех её солях |
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | F2 Cl2 Br2 I2 | Фтор Хлор Бром Йод | Светло-зеленый газ Желто-зеленый газ Темно-красная жидкость Серо-черные кристаллы |
| -1 | HF HCl HBr HI | Фтороводород (соли кислоты: фториды) Хлороводород (соли кислоты: хлориды) Бромоводород (соли кислоты: бромиды) Йодоводород (соли кислоты: йодиды) | Бесцветные ядовитые газы. При растворении в воде образуют соответствующие кислоты. |
| +1 | HClO HBrO HIO | Хлорноватистая кислота (соли: гипохлориты) Бромноватистая кислота (соли: гипобромиты) Йодноватистая кислота (соли: гипоиодиты) | В приведенных кислотах, а также всех их солях |
| +3 | HClO2 HBrO2 HIO2 | Хлористая кислота (соли: хлориты) Бромистая кислота (соли: бромиты) Йодистая кислота (соли: иодиты) | В приведенных кислотах, а также всех их солях |
| +5 | HClO3 HBrO3 HIO3 | Хлорноватая кислота (соли: хлораты) Бромноватая кислота (соли: броматы) Йодноватая кислота (соли: иодаты) | В приведенных кислотах, а также всех их солях |
| +7 | HClO4 HBrO4 HIO4 | Хлорная кислота (соли: перхлораты) Бромная кислота (соли: перброматы) Йодная кислота (соли: периодаты) | В приведенных кислотах, а также всех их солях |
* Для фтора только 0 и -1; At также является галогеном, но его не рассматриваем, так как в природе его практически нет.
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | C | Углерод | Аллотропные модификации: алмаз, графит, карбин (черный порошок, полимерные цепи -CC-, =С=С=), фуллерены (темные, похожие на сажу, C60-C200) |
| +2 | CO | Оксид углерода (II) (угарный газ) | В таких соединениях как CO, а также в некоторых органических соединениях |
| +4 | CO2 |
** В органических соединениях углерод проявляет все степени окисления от -4 (например, CH4) до +3 (например, CH3COOH).
Читайте также:

