Дифференциальная диагностика острого лейкоза с апластической анемией
Абсолютно патогномоничных симптомов при остром лейкозе не существует. Следует еще раз подчеркнуть, что важнейшим признаком острого лейкоза является обнаружение в стернальном пунктате властных клеток в количестве, превышающем 20%. Существует ряд заболеваний, которые в силу сходства клинических и лабораторных признаков необходимо дифференцировать с острым лейкозом.
Основными дифференциально-диагностическими различиями между лейкемоидными реакциями и острым лейкозом являются следующие:
• наличие четкой связи между перенесенной бактериальной или вирусной инфекцией и развитием лейкемоидной реакции. При остром лейкозе такая связь не характерна, однако следует помнить, что начало острого лейкоза может протекать под видом вирусной инфекции;
• купирование инфекционно-воспалительного процесса приводит к нормализации периферической крови и миелограммы;
• отсутствие тромбоцитопении и геморрагического синдрома при лейкемоидной реакции, в то время как для острого лейкоза тромбоцитопения и тяжелый геморрагический синдром закономерны;
• наличие токсической зернистости нейтрофилов характерно для лейкемоидной реакции и не наблюдается при остром лейкозе;
• отсутствие бластемии в периферической крови и костном мозге при лейкемоидной реакции является важнейшей особенностью лейкемоидной реакции, при остром лейкозе, напротив, чрезвычайно характерно высокое содержание бластов в костном мозге.
Главным отличительным признаком лейкемоидных реакций является тенденция к обратному развитию и полная нормализация картины периферической крови и миелограммы после купирования первичного этиологического фактора.
Гипопластическая анемия и агранулоцитоз. Дифференцировать эти заболевания приходится потому, что картина периферической крови при гипопластической анемии и агранулоцитозе может быть сходна с картиной крови при алейкемической форме лейкоза. Гипопластическая анемия, как и алейкемический вариант острого лейкоза, сопровождается панцитопенией и геморрагическим синдромом. Отличить гипопластическую анемию от острого лейкоза можно на основании следующих признаков:
· при гипопластической анемии в периферической крови никогда не определяются бласты;
· гипопластическая анемия не сопровождается выраженным синдромом интоксикации и гиперпластическим синдромом;
· при гипопластической анемии нет спленомегалии и лимфаденопатии;
· при гипопластической анемии в стернальном пунктате количество бластных клеток нормальное, а в трепанобиоптате определяется выраженное преобладание жировой ткани.
Агранулоцитоз достаточно легко отличить от острого алейкемического лейкоза на основании следующих положений: агранулоцитоз не сопровождается бластозом костного мозга (количество бластов в стернальном пунктате нормальное); нет редукции красного ростка и мегакариоцитарного ростка кроветворения (количество мегакариоцитов в стернальном пунктате нормальное); не бывает увеличения селезенки; отсутствует геморрагический синдром.
Метастазы злокачественной опухоли в костный мозг. При метастазах злокачественной опухоли в костный мозг происходит замещение нормальной кроветворной ткани злокачественными опухолевыми клетками. При этом развивается тяжелая анемия, возможно развитие тромбоцитопении и лейкопении, т.е. картина крови становится сходной с той, которая характерна для алейкемической формы острого лейкоза. Исключить острый лейкоз в этой ситуации позволяет исследование стернального пунктата, в котором отсутствует бластная пролиферация, и определяется большое количество атипичных опухолевых клеток. Кроме того, следует принять во внимание, что при метастазах опухоли в костный мозг, как правило, удается выявить клинические признаки злокачественной опухоли различной локализации. Наиболее часто метастазируют в костный мозг рак желудка, молочной железы.
Бластная метаплазия костного мозга является ведущим признаком в установлении диагноза острого лейкоза. Следует подчеркнуть, что увеличение числа бластов в костном мозге наблюдается также при других гемобластозах: рефрактерной анемии с избытком бластов миелодиспластического синдрома (РАИБ МДС), бластном кризе мие-лопролиферативных заболеваний (МПЗ), миело- и лимфосаркомах в стадии бластной лейкемизации. В связи с этим обнаружение повышенного числа бластов в костном мозге и крови требует проведения дифференциальной диагностики острого лейкоза от этих гемобластозов. В большинстве случаев это не представляет больших трудностей, однако до настоящего времени остаются проблемы, которые пока не удалось разрешить окончательно.
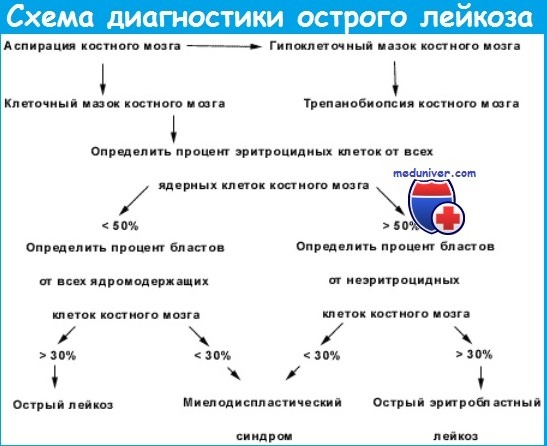
Ведущим признаком для разделения острого нелимфобластного лейкоза и РАИБ МДС является условный показатель — содержание бластов в миелограмме. При количестве бластных клеток 20 % и более ставят диагноз острого лейкоза, менее 20 % — миелодиспластический синдром (МДС). В тех случаях, когда количество клеток красного ряда в костном мозге превышает 50 %, пересчитывают содержание бластных элементов в неэритроидной фракции костного мозга (гранулоциты вместе с лимфоцитами и моноцитами). Если число бластов превышает 20 %, диагностируют острый эритромиелоз, в противоположном случае — МДС.
В классификации ВОЗ подчеркивается, что в тех случаях, когда в бластах выявляются палочки Ауэра или обнаруживаются специфические аномалии кариотипа t(8;21), inv(16) и t(l6;l6), диагноз ОНЛЛ устанавливают при числе бластов менее 20 %.
Цитопения в крови, мегалобластоидные изменения эритропоэза и дисплазия грануло- и мегакариоцитопоэза характерны в такой же степени для В12- и фолатдефицитной анемии, как и для лейкозов. Исследование костного мозга, уровня витамина В,2 и В12-связывающей способности сыворотки, а также адекватный ответ на терапию витамином В12 или фолатом позволяют отличить эти анемии от гемобластозов. Констатация ретикулоцитарного криза (число ретикулоцитов превышает 30—40 %) на 5—6-й день лечения с несомненностью указывает на эффективность проводимого лечения и подтверждает диагноз В12-дефицитной анемии.
Диагностика гемобластоза бывает сложной при скудных пунктатах костного мозга. Это может наблюдаться при апластических состояниях, миелофиброзе, МДС с фиброзом или метастазах опухоли. В тех случаях, когда идентифицирован пролиферирующий патологический клон (миелобласты, мегакариобласты), диагностируют острый лейкоз с миелофиброзом, в противном случае — острый или хронический идиопатический миелофиброз. При остром панмиелозе в отличие от хронического идиопатического миелофиброза в костном мозге преобладают молодые формы миелопоэза, в том числе одноядерные мегакариоциты.
Острые лейкозы приходится также дифференцировать от бластных кризов при МПЗ и, в частности, ХМЛ. Особые затруднения представляют случаи, когда ХМЛ манифестирует с бластного криза. Наличие Ph-хромосомы в большинстве случаев помогает установлению диагноза ХМЛ. Следует отметить, что филадельфийская хромосома выявляется также в редких случаях миелобластных и в 25 % лимфобластных лейкозов, что затрудняет диагностику. Властные кризы ХМЛ могут быть миелоидными и лимфоидными, и дифференциальная диагностика проводится с соответствующим вариантом острого лейкоза. Картина костного мозга при миелоидном бластном кризе ХМЛ отличается гораздо большей пестротой, чем при ОНЛЛ: в гранулоцитарном ростке могут присутствовать эозинофилы, базофилы, обнаруживаются патологические микроформы мегакариоцитов.
Клетки в бластной популяции более разнообразны по своим морфоиммунологическим признакам по сравнению с острым лейкозом, могут одновременно выявляться миелобласты, эритробласты, мегакариобласты, а в части случаев и лимфобласты. Картина лимфоидного бластного криза более мономорфна и сходна с таковой при ОЛЛ. Ph-позитивный клон при ХМЛ и ОЛЛ различны по своим функциональным особенностям, что связано с особенностями строения онкогенов BCR/ABL при этих двух гемобластозах. При ОЛЛ ген BCR/ABL кодирует патологический белок р190, при ХМЛ продуцируется белок р210. С помощью молекулярных методов исследования (реакция PCR) устанавливают точный диагноз.
Определенные диагностические трудности могут встречаться также при дифференциальной диагностике ОНЛЛ и метастазов альвеолярной рабдомиосаркомы и нейробластомы у детей.
Дифференциальная диагностика острого лимфобластного лейкоза и неходжкинских лимфом (НХЛ) в стадии лейкемизации по бластному типу вызывает необходимость детального иммунологического исследования. Те гемобластозы, при которых бласты имеют фенотип ранних предшественников, обозначаются как ОЛЛ/НХЛ, а остальные — как НХЛ из периферических клеток. Так, при экспрессии антигенов ранних В-предшественников (CD19, CD20, CD22), фермента TdT и отсутствии мембранного иммуноглобулина ставят диагноз В-ОЛЛ/НХЛ, а при наличии фенотипа Т-предшественников - Т-ОЛЛ/НХЛ.
Аналогичные трудности встречаются при дифференциальной диагностике острого нелимфобластного лейкоза (ОНЛЛ) и миелоидных сарком. В настоящее время миелоидные саркомы в классификации ВОЗ рассматриваются в разделе острых лейкозов и могут представляться как первое проявление заболевания с быстрой лейкемизацией по типу острого нелимфобластного лейкоза (ОНЛЛ).
Клеточный состав миелосаркомы может быть представлен бластами разных типов или созревающими элементами гранулоцитарного ряда. Морфоцитохимическая и иммунофенотипическая характеристика бластов, цитогенетические аномалии идентичны наблюдаемым при остром нелимфобластном лейкозе (ОНЛЛ).
У больных множественной миеломой может наблюдаться плазмоклеточный лейкоз. Обычно он проявляется как терминальная фаза миеломной болезни, хотя встречаются описания случаев, когда он расценивается как самостоятельное заболевание. Лейкемическая популяция в крови и костном мозге представлена плазмобластами, а также проплазмоцитами и плазматическими клетками. Все элементы плазматического ряда морфоцитохимически и иммунофенотипически характеризуются как В-клетки с клональной экспрессией иммуноглобулинов.
27. Дифференциальная диагностика острого лейкоза и апластической анемии.
Апластическая анемия — состояние, при котором имеет место панцитопения, сочетающаяся со снижением кроветворения в костном мозге, без признаков гемобластоза.
Апластической анемии ставят на основании не только обнаружения панцитопении в периферической крови, но и тщательного цитологического и гистологического исследования костного мозга, что необходимо прежде всего для исключения гемобластозов. При периферической панцитопении возникает необходимость исключения группы анемий, связанных с нарушением синтеза ДНК и РНК (мегалобластных анемий). У пожилых людей — это в первую очередь В12 — дефицитные анемии, у детей — фолиеводефицитные анемии. При этом имеет место гиперплазия костного мозга, выявляемая при трепанобиопсии, в костном мозге обнаруживаются мегалобласты. Наличие признаков внутрисосудистого гемолиза (обнаружение гемосидерина в моче, увеличение свободного гемоглобина плазмы, повышение ретикулоцитов, раздражение красного ростка костного мозга) может говорить либо в пользу болезни Маркиафавы — Микели, что может быть подтверждено положительной сахарозной пробой и пробой Хема, либо в пользу аутоиммунной панцитопении, которая может быть особенно вероятна при наличии положительной агрегатгемагглютинационной пробы.
При цитогенетическом исследовании выявляют специфические хромосомные повреждения, наличие которых помогает определить подвид лейкоза и оценить агрессивность заболевания. В ряде случаев назначается молекулярно-генетическая диагностика, способная выявить генетические нарушения на молекулярном уровне. образце костного мозга, получаемом из грудины или подвздошной кости, при остром лейкозе выявляют замещение нормальных клеток незрелыми опухолевыми клетками (бластами). ммунофенотипирование проводится методом проточной цитометрии и позволяет определить, к какому подвиду лейкоза принадлежит данное заболевание, что имеет важное значение для выбора оптимальной программы лечения.
Острый лейкоз — клональное (онкологическое) заболевание, первично возникающее в костном мозге в результате мутации стволовой клетки крови. Следствием мутации является потеря потомками мутировавшей клетки способности к дифференцировке до зрелых клеток крови. Морфологический субстрат оcтpыx лейкозов — бластные клетки.
Характерна комбинация синдромов недостаточности костного мозга и признаков специфического поражения.
В связи с лейкозной инфильтрацией слизистых оболочек полости рта и ткани миндалин появляются некротический гингивит, тонзиллит (некротическая ангина). Иногда присоединяется вторичная инфекция и развивается сепсис, приводящий к смерти.
Тяжесть состояния больного может быть обусловлена выраженной интоксикацией, геморрагическим синдромом, дыхательной недостаточностью (вследствие сдавления дыхательных путей увеличенными внутригрудными лимфатическими узлами).
Дифференциальный диагноз острого лейкоза и апластической анемии
Исследование костного мозга практически всегда позволяет исключить негематологическую патологию, поскольку при остром лейкозе отмечается повышение содержания бластных клеток. Обнаружение не менее 20% типичных бластных клеток в мазке периферической крови и/или костного мозга позволяет исключить большинство гематологических заболеваний, имеющих сходные клинико-лабораторные проявления.

Исключение составляют:
1) один из вариантов миелодиспластического синдрома (МДС) (рефрактерная анемия с избытком бластов — РАИБ), который обычно отличается от острого лейкоза лишь процентным содержанием бластных клеток в костном мозге;
2) бластный криз хронического миелобластного лейкоза.

У 30% больных старше 60 лет развитию острого миелобластного лейкоза предшествует один из вариантов миелодиспластического синдрома (МДС) (чаще всего РАИБ). В обоих случаях результаты лечения и прогноз обычно неблагоприятны, поэтому различия между рефрактерной анемией с избытком бластов (РАИБ) и вторичным острым миелобластным лейкозом (ОМЛ), развившемся из миелодиспластического синдрома (МДС), не имеют существенного клинического значения.
Для дифференциальной диагностики с бластным кризом хронического миелобластного лейкоза (ХМЛ) необходимо учитывать анамнез заболевания, клинические данные, результаты цитогенетического исследования и иммунофенотипирования. При формулировке диагноза необходимо выделять вторичные острые лейкозы (почти всегда — острые миелобластные лейкозы (ОМЛ)), развившиеся после проведения лучевой и/или химиотерапии по поводу опухолевых и неопухолевых заболеваний.
Дифференциальный диагноз острого лейкоза и апластической анемии
Бластная метаплазия костного мозга является ведущим признаком в установлении диагноза острого лейкоза. Следует подчеркнуть, что увеличение числа бластов в костном мозге наблюдается также при других гемобластозах: рефрактерной анемии с избытком бластов миелодиспластического синдрома (РАИБ МДС), бластном кризе мие-лопролиферативных заболеваний (МПЗ), миело- и лимфосаркомах в стадии бластной лейкемизации. В связи с этим обнаружение повышенного числа бластов в костном мозге и крови требует проведения дифференциальной диагностики острого лейкоза от этих гемобластозов. В большинстве случаев это не представляет больших трудностей, однако до настоящего времени остаются проблемы, которые пока не удалось разрешить окончательно.
Ведущим признаком для разделения острого нелимфобластного лейкоза и РАИБ МДС является условный показатель — содержание бластов в миелограмме. При количестве бластных клеток 20 % и более ставят диагноз острого лейкоза, менее 20 % — миелодиспластический синдром (МДС). В тех случаях, когда количество клеток красного ряда в костном мозге превышает 50 %, пересчитывают содержание бластных элементов в неэритроидной фракции костного мозга (гранулоциты вместе с лимфоцитами и моноцитами). Если число бластов превышает 20 %, диагностируют острый эритромиелоз, в противоположном случае — МДС.
В классификации ВОЗ подчеркивается, что в тех случаях, когда в бластах выявляются палочки Ауэра или обнаруживаются специфические аномалии кариотипа t(8;21), inv(16) и t(l6;l6), диагноз ОНЛЛ устанавливают при числе бластов менее 20 %.
Цитопения в крови, мегалобластоидные изменения эритропоэза и дисплазия грануло- и мегакариоцитопоэза характерны в такой же степени для В12- и фолатдефицитной анемии, как и для лейкозов. Исследование костного мозга, уровня витамина В,2 и В12-связывающей способности сыворотки, а также адекватный ответ на терапию витамином В12 или фолатом позволяют отличить эти анемии от гемобластозов. Констатация ретикулоцитарного криза (число ретикулоцитов превышает 30—40 %) на 5—6-й день лечения с несомненностью указывает на эффективность проводимого лечения и подтверждает диагноз В12-дефицитной анемии.

Диагностика гемобластоза бывает сложной при скудных пунктатах костного мозга. Это может наблюдаться при апластических состояниях, миелофиброзе, МДС с фиброзом или метастазах опухоли. В тех случаях, когда идентифицирован пролиферирующий патологический клон (миелобласты, мегакариобласты), диагностируют острый лейкоз с миелофиброзом, в противном случае — острый или хронический идиопатический миелофиброз. При остром панмиелозе в отличие от хронического идиопатического миелофиброза в костном мозге преобладают молодые формы миелопоэза, в том числе одноядерные мегакариоциты.
Острые лейкозы приходится также дифференцировать от бластных кризов при МПЗ и, в частности, ХМЛ. Особые затруднения представляют случаи, когда ХМЛ манифестирует с бластного криза. Наличие Ph-хромосомы в большинстве случаев помогает установлению диагноза ХМЛ. Следует отметить, что филадельфийская хромосома выявляется также в редких случаях миелобластных и в 25 % лимфобластных лейкозов, что затрудняет диагностику. Властные кризы ХМЛ могут быть миелоидными и лимфоидными, и дифференциальная диагностика проводится с соответствующим вариантом острого лейкоза. Картина костного мозга при миелоидном бластном кризе ХМЛ отличается гораздо большей пестротой, чем при ОНЛЛ: в гранулоцитарном ростке могут присутствовать эозинофилы, базофилы, обнаруживаются патологические микроформы мегакариоцитов.
Клетки в бластной популяции более разнообразны по своим морфоиммунологическим признакам по сравнению с острым лейкозом, могут одновременно выявляться миелобласты, эритробласты, мегакариобласты, а в части случаев и лимфобласты. Картина лимфоидного бластного криза более мономорфна и сходна с таковой при ОЛЛ. Ph-позитивный клон при ХМЛ и ОЛЛ различны по своим функциональным особенностям, что связано с особенностями строения онкогенов BCR/ABL при этих двух гемобластозах. При ОЛЛ ген BCR/ABL кодирует патологический белок р190, при ХМЛ продуцируется белок р210. С помощью молекулярных методов исследования (реакция PCR) устанавливают точный диагноз.
Определенные диагностические трудности могут встречаться также при дифференциальной диагностике ОНЛЛ и метастазов альвеолярной рабдомиосаркомы и нейробластомы у детей.

Дифференциальная диагностика острого лимфобластного лейкоза и неходжкинских лимфом (НХЛ) в стадии лейкемизации по бластному типу вызывает необходимость детального иммунологического исследования. Те гемобластозы, при которых бласты имеют фенотип ранних предшественников, обозначаются как ОЛЛ/НХЛ, а остальные — как НХЛ из периферических клеток. Так, при экспрессии антигенов ранних В-предшественников (CD19, CD20, CD22), фермента TdT и отсутствии мембранного иммуноглобулина ставят диагноз В-ОЛЛ/НХЛ, а при наличии фенотипа Т-предшественников — Т-ОЛЛ/НХЛ.
Аналогичные трудности встречаются при дифференциальной диагностике острого нелимфобластного лейкоза (ОНЛЛ) и миелоидных сарком. В настоящее время миелоидные саркомы в классификации ВОЗ рассматриваются в разделе острых лейкозов и могут представляться как первое проявление заболевания с быстрой лейкемизацией по типу острого нелимфобластного лейкоза (ОНЛЛ).
Клеточный состав миелосаркомы может быть представлен бластами разных типов или созревающими элементами гранулоцитарного ряда. Морфоцитохимическая и иммунофенотипическая характеристика бластов, цитогенетические аномалии идентичны наблюдаемым при остром нелимфобластном лейкозе (ОНЛЛ).
У больных множественной миеломой может наблюдаться плазмоклеточный лейкоз. Обычно он проявляется как терминальная фаза миеломной болезни, хотя встречаются описания случаев, когда он расценивается как самостоятельное заболевание. Лейкемическая популяция в крови и костном мозге представлена плазмобластами, а также проплазмоцитами и плазматическими клетками. Все элементы плазматического ряда морфоцитохимически и иммунофенотипически характеризуются как В-клетки с клональной экспрессией иммуноглобулинов.
Повышение оригинальности
Результат поиска
Зав.кафедрой: д.м.н.,
профессор Хмелевская И.Г.
Преподаватель: к.м.н.,
доцент Клюй И.Е.
Выполнила:
студентка 5 курса 17 группы
лечебного факультета
Список используемой литературы
Клинические проявления острого лейкоза являются следствием пролиферации и накопления злокачественных лейкозных бластных клеток. количественно превышающих условный рубеж (более 1000 млрд) за которым истощаются компенсаторные возможности организма.
Клиническая симптоматика развернутой стадии ОЛ складывается из 5 основных синдромов:
1. гиперпластического
2. геморрагического
3. анемического
4. интоксикационного
5. инфекционный осложнений
Заболевание развивается быстро. Температура тела поднимается до высоких цифр, нарастает общая слабость, беспокоит озноб, сильная потливость, аппетит отсутствует, бывает носовое кровотечение.
В клинической картине можно выделить несколько синдромов: анемический, геморрагический, интоксикационный, иммунодефицитный, гиперпластический.
При осмотре можно обнаружить многочисленные кровоизлияния на коже. Развивается стоматит, некротическая ангина, шейные и поднижнечелюстные лимфатические узлы увеличены, подкожная жировая клетчатка в области шеи отечна. Наблюдается желудочное кровотечение при разрушении лейкозных инфильтратов стенки желудка. В зависимости от формы острого лейкоза увеличиваются селезенка, печень, лимфатические узлы.
Основной клинической симптоматикой \ОЛ служат процессы гиперплазии опухолевой ткани (бластная трансформация костного мозга, увеличение лимфатических узлов, органов, появление опухолевых инфильтратов и т.д,) и признаки подавления нормального кроветворения. Клиническая симптоматика развернутой стадии ОЛ складывается из 5 основных синдромов:
1. гиперпластического
2. геморрагического
5. инфекционный осложнений
Гиперпластический синдром проявляется умеренным и безболезненным увеличением лимфоузлов, печени, селезенки (30-50%), у 1\4 больных — увеличение миндалин, лимфоузлов средостения с симптомами сдавления. появляются кожные лейкозные инфильтраты (лейкемиды) в виде красновато-синеватых бляшек.
Лейкозная гиперплазия и инфильтрация костного мозга приводят к угнетению нормального кроветворения, в результате чего развивается анемия и тромбоцитопения. тяжелая анемия с гемоглобином ниже 60 г\л, эритроциты менее 1-1,3х1012 отмечается у 30%. Глубокая тромбоцитопения (ниже 50х109\л) служит основной причиной одного из самых коварных клинических синдромов — геморрагического, который наблюдается у 50-60% больных. Геморрагические проявления весьма вариабельны: от мелкоточечных и мелкопятнистых единичных высыпаний на коже и слизистых оболочках до обширных кровоизлияний и профузных кровотечений — носовых, маточных, желудочно-кишечных и др.
Кровоизлияния очень часто сопровождаются неврологическими нарушениями, острыми расстройствами мозгового кровообращения.
инфекционные процессы., наблюдаемые у 80-85% больных ОЛ, являются грозным, труднокупируемым осложнением. Наиболее многочисленная группа инфекционных осложнений бактериального происхождения 70-80%, включающая пневмонии, сепсис, гнойные процессы. Тяжелые инфекционные осложнения вирусного и грибкового генеза наблюдаются реже у 4-18 и 18-30% больных. В последнее время уменьшилась роль стафилококковой инфекции и возросло значение грамотрицательной флоры. количество грибковых инфекций обнаруживает тенденцию к увеличению До20%. Вирусные инфекции стали протекать тяжелее, участились случаи цитомегаловирусной инфекции, герпеса.
Клиническим проявлением локализации лейкозного процесса в оболочках и веществе головного мозга является синдром нейролейкоза. клиническая симптоматика нейролейкоза развивается постепенно и складывается из симптомов повышения внутричерепного давления и локальной симптоматики: менингоэнцефалический синдром, псевдотуморозный, расстройства функций черепно-мозговых нервов, поражение периферических нервов.
Картина крови в развернутой стадии острого лейкоза весьма характерна. Помимо анемии и тромбоцитопении отмечается изменение числа лейкоцитов в довольно широких пределах: от 0,1х109\л До 100х109\л с преобладанием форм с нормальным и сниженным лейкопеническим (38%) или сублейкимическим (44%) числом лейкоцитов. Лишь у 18% больных количество лейкоцитов превышает 50х109\л. У 30% больных бластные клетки в гемограмме отсутствуют. У большинства больных количество бластных форм составляет от нескольких процентов Дорошев80-90%. Клеточный состав гемограммы часто бывает мономорфным, представленный в основном бластными клетками.Зрелые гранулоциты выявляются в виде единичных палочкоядерных и сегментоядерных нейтрофилов. Между бластными клетками и зрелыми гранулоцитами почти нет промежуточных форм, что отражает провал в кроветворении — лейкемическое зияние (hiatus leukemicus). При нелимфобластных острых лейкозах в гемограмме могут обнаруживаться незрелые гранулоциты: промиелоциты, миелоциты, метамиелоциты, однако их количество невелико (Не более 10%).
Иногда возникает затруднение в дифференциальной диагностике острого лейкоза и иммунного лизиса, приводящего к анемии, тромбоцитопении и нейтропении, к панцитолизу. Иммунный панцитолиз сопровождается выраженным геморрагическим синдромом и вялотекущими осложнениями инфекционной природы, обусловленными нейтропенией. В крови могут появляться бласттрансформированные лимфоциты, которые ошибочно, особенно в толстом мазке, можно принять за бластные клетки. Однако в материалах пункции и трепанобиопсии при иммунном лизисе в отличие от острого лейкоза костный мозг полиморфен, в нем содержится немало мегакариоцитов и отсутствуют типичные бластные клетки, пробы на антитела к эритроцитам и тромбоцитам положительны.
Список используемой литературы
-
Закиряходжаев Д.З., Торубарова Д.А., Кадагидзе З.Г. и др. Клинико иммунологические исследования у больных с нефробластомой и нейробластомой. Актуальные вопросы онкологии.. — М., -2008с.
Литвицкий П. Ф. Патофизиология: Учебник: в 2–х томах.– М.:ГЭОТАР–МЕД, 2009. – Т 2,
Справочник врача общей практики. В 2-х томах. / Под ред. Воробьева Н.С. –М.: Изд-во Эксмо, 2005 — 310с.
Волкова М.А. Клиническая онкогематология. М-2007
Н.Н. Петрищев, Л.П. Папаян. Гематология. М-2009
Перейти к полному тексту работы
Скачать работу с онлайн повышением оригинальности до 90% по antiplagiat.ru, etxt.ru
Смотреть полный текст работы бесплатно
Смотреть похожие работы
* Примечание. Уникальность работы указана на дату публикации, текущее значение может отличаться от указанного.
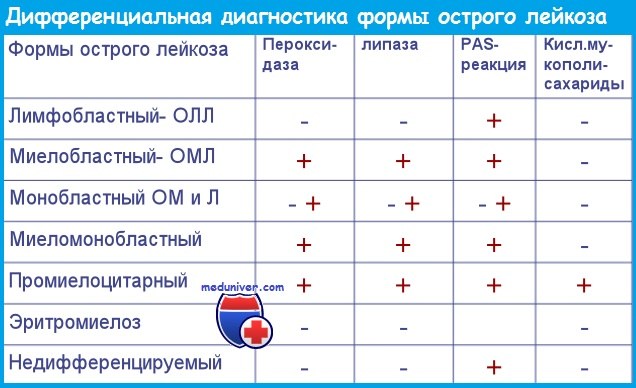
ОЛ.Дифференциальный диагноз острых лейкозов проводится с бластным кризом хронического миелолейкоза, злокачественной неходжкинской лимфомой в стадии лейкемизации, апластической анемией, инфекционным мононуклеозом. Значительно реже возникает необходимость исключить агранулоцитоз, реактивный или обусловленный метастазом солидной опухоли лимфаденит, диффузные заболевания соединительной ткани.
Основой для верификации диагноза является исследование миелограммы: обнаружение нескольких десятков типичных бластных клеток исключает практически все перечисленные заболевания. Сложности могут возникнуть лишь в дифференциальной диагностике острого лейкоза с хроническим миелолейкозом, дебютировавшим с бластного криза, а также неходжкинской злокачественной лимфомой высокой степени злокачествености в фазе лейкемизации. В обоих случаях аспират костного мозга, как и при остром лейкозе, содержит большое количество бластных клеток, что при отсутствии анамнестических сведений о хроническом миелолейкозе или злокачественной неходжкинской лимфоме делает проведение дифференциального диагноза крайне затруднительным. Однако в клинической практике такая дифференциальная диагностика является желательной, но не обязательной, поскольку лечение острого лейкоза, бластного криза хронического миелолейкоза и лейкемизированной лимфомы высокой степени злокачественности проводится по идентичным программам полихимиотерапии.
ХМ. Проводится с доброкачественным сублейкемическим миелозом (миелофиброзом). Последний характеризуется многолетним умеренным лейкоцитозом в пределах 10-30х109/л с нейтрофилезом и сдвигом формулы влево до единичных миелоцитов, наличием в трепанате костного мозга явлений миелофиброза и остеосклероза. Кроме того, в отличие от ХМЛ при сублейкемическом миелозе на ранних стадиях заболевания обнаруживается выраженная спленомегалия. Помощь в дифференциальной диагностике могут оказать кариологические исследован
ия, позволяющие определить отсутствие филадельфийской хромосомы. С ХМЛ приходится дифференцировать лейкемоидные реакции, развивающиеся при различных заболеваниях. Так, группа септических и других инфекционных заболеваний вызывает развитие нейтрофильного лейкоцитоза со сдвигом влево, но, как правило до миелоцитов. При этом обращает внимание токсическая зернистость нейтрофилов. Следует иметь ввиду также возможность лейкемоидных реакций миелоидного типа при раках различной локализации.
Б-8
1. Ишемическая болезнь сердца. Острый инфаркт миокарда. Этиология, патогенез, классификация, клинические варианты течения, диагностика, осложнения. Современные принципы лечения. Военно-врачебная экспертиза.
Инфаркт миокарда - острое заболевание, обусловленное возникновением одного или нескольких очагов ишемического некроза в сердечной мышце в связи с абсолютной или относительной недостаточностью коронарного кровотока. У мужчин инфаркт миокарда встречается чаще, чем у женщин, особенно в молодом возрасте. В возрасте 41-50 лет это соотношение равняется 5:1, а в период 51-60 лет - 2:1. Позднее разница исчезает за счет роста частоты инфаркта у женщин.
Э т и о л о г и я. У подавляющего большинства больных в возникновении инфаркта миокарда основное значение имеет атеросклероз коронарных артерий. Реже его причиной бывает эмболия венечных сосудов при заболеваниях, ведущих к появлению тромбов в полостях сердца и на клапанах, при коронаритах. В этих случаях инфаркт не относят к ИБС, а рассматривают в рамках основного заболевания (узелковый периартериит, инфекционный эндокардит).
П а т о г е н е з. Нарушение коронарного кровообращения происходит в результате возникновения несоответствия между потребностью миокарда в кислороде и его кровоснабжением по коронарным артериям. Недостаточность коронарного кровообращения может развиться в результате острого прекращения кровотока по коронарному руслу или при повышении потребления кислорода миокардом и невозможности адекватного увеличения кровотока. Основными звеньями патогенеза инфаркта миокарда являются несколько факторов, действующих по типу "порочного круга": спазм артерии – агрегация тромбоцитов - тромбоз и усиление спазма - высвобождение вазоконстрикторных веществ из тромбоцитов - спазм и усиление тромбоза. Агрегация тромбоцитов усиливается при атеросклерозе. Дополнительным фактором, способствующим тромбозу, является замедление скорости кровотока в стенозированных коронарных артериях или при их спазме.
К л и н и ч е с к а я к а р т и н а. Основным клиническим симптомом типичной формы инфаркта миокарда является болевой приступ. Боль обычно локализуется в области сердца и иррадиациирует в левую руку, в шею, в челюсть. Возможна более широкая ее иррадиация (на всю переднюю поверхность грудной клетки). Характерной для инфаркта миокарда является боль, превосходящая по интенсивности и длительности обычный приступ стенокардии. Боль имеет разнообразный характер (давящая, сжимающая, жгучая, режущая), не снимается нитроглицерином. Типичной особенностью ее является волнообразное нарастание и уменьшение, выраженная эмоциональная окраска: больные испытывают чувство страха смерти, возбуждены, беспокойны. При общем осмотре отмечается бледность кожи, повышенная потливость. На второй-третий день возможно повышение температуры тела (обычно не выше 38,5 оС). При исследовании сердечно-сосудистой системы можно отметить
акроцианоз, ослабление I тона на верхушке сердца, появление маятникообразного ритма или "ритма галопа" (синдром поражения миокарда). При некрозе папиллярных мышц возможно формирование относительной недостаточности митрального клапана - смещение кнаружи верхней и левой границ относительной сердечной тупости, систолический шум на верхушке и в 5-ой точке.
В самом начале болевого приступа артериальное давление может несколько повышаться, но затем, как правило, снижается в связи с уменьшением сердечного выброса. Обследование других систем выявляет признаки развивающихся осложнений заболевания, о которых будет сказано далее. Из атипичных форм инфаркта миокарда наиболее часто встречается астматический вариант, протекающий по типу сердечной астмы или отека легких. Он наблюдается при обширном поражении сердечной мышцы, при повторных инфарктах, на фоне уже существующей не-
достаточности кровообращения, при наличии кардиосклероза. Внезапное развитие у больного с ишемической болезнью сердца приступа сердечной астмы всегда требует обследования для исключения этой формы заболевания. Абдоминальный вариант возможен при диафрагмальном инфаркте миокарда. Для него характерны боли в верхней части живота, диспептические явления (метеоризм, тошнота, рвота).
Аритмический вариант начинается с различных нарушений ритма: приступов мерцательной аритмии, тахикардии, частой экстрасистолии. Боль при этом отсутствует или появляется после возникшей аритмии. Цереброваскулярная форма может протекать в виде обморока или инсульта. Нарушение мозгового кровообращения обычно имеет преходящий характер. К атипичным формам относится и бессимптомный инфаркт миокарда, проявляющийся лишь ухудшением общего самочувствия, слабостью. Этот вариант особенно труден для диагностики и нередко
распознается только впоследствии по данным ЭКГ.
Течение. Продромальный период иначе называется прединфарктным состоянием. Он проявляется учащением приступов стенокадии, их утяжелением, однако, у ряда больных может отсутствовать. Острейший период - время между возникновением резкой ишемии участка миокарда и появлением признаков его некроза. Он продолжается от 30 минут до 4 часов. Считается, что если в этот период под влиянием тромболитической терапии происходит резорбция тромба, возможно предотвращение некроза сердечной мышцы с обратным развитием электрокардиографических симптомов. Острый период, в течение которого образуется участок некроза и миомаляции, длится от 2 до 10 дней. Подострый период, во время которого завершаются начальные процессы организации рубца (некротические массы полностью замещаются грануляционной тканью) длится от 4 до 8 недель. Послеинфарктный период, характеризующийся увеличением плотности рубца и адаптацией миокарда к новым условиям функционирования сердечно-сосудистой системы, продолжается в течение 2-6 месяцев с момента образования некроза.
Осложнения. Одной из самых частых причин летального исхода является кардиогенный шок. Обычно он развивается в первые часы
возникновения инфаркта, чаще на фоне выраженного болевого синдрома и протекает в четырех формах. Истинный кардиогенный шок
развивается в связи с резким падением сократительной функции левого желудочка; минутный объем при этом уменьшается столь значительно, что не компенсируется повышением периферического сосудистого сопротивления. Это приводит к резкому падению артериального давления. Рефлекторный шок возникает вследствие рефлекторных нарушений, вызывающих изменение сосудистого тонуса. Ареактивный - шок, не поддающийся лечению возрастающими дозами гипертензивных средств в течение 15-20 минут. Аритмический шок патогенетически связан с возникновением нарушений ритма. Клиническими проявлениями шока являются бледность с цианотическим оттенком, похолодание кожи, заостренные черты лица, выраженная потливость, снижение систолического давления до 80 мм рт.ст., олигурия. Другим осложнением острого периода инфаркта является острая левожелудочковая недостаточность, проявляющаяся сердечной астмой и отеком легких. Она возникает вследствие обширного поражения сердечной мышцы. Реже наблюдается острая правожелудочковая недостаточность, развивающаяся при локализации некроза в межжелудочковой перегородке. Почти все случаи инфаркта миокарда сопровождаются различными нарушениями ритма и проводимости (экстрасистолия, мерцательная аритмия, различные блокады проведения импульса). Они возникают в результате электрической нестабильности миокарда, когда различные его участки имеют разные электрофизиологические свойства. Наиболее грозным нарушением ритма является фибрилляция желудочков - основная причина смерти больных. При обширном трансмуральном инфаркте может развиться аневризма сердца, которая формируется в период развития миомаляции (в остром периоде). Реже она возникает в подостром периоде за счет растяжения неокрепшего рубцового поля. Основным клиническим проявлением аневризмы является прогрессирующая недостаточность кровообращения. Иногда при этом можно обнаружить патологическую пульсацию в 3-4 межреберьях кнаружи от срединноключичной линии. Источником тромбоэмболий при инфаркте миокарда являются внутриполостные тромбы. Факторами, способствующими тромбообразованию, являются акинезия поврежденного участка сердечной мышцы, развитие локального эндокардита, нарушение свертывания крови. Чаще всего при этом осложнении наблюдаются симптомы нарушения мозгового кровообращения, нарушение проходимости магистральных сосудов конечностей, мезентериальных сосудов. Наиболее грозным осложнением является разрыв миокарда вследствие несостоятельности некротизированной сердечной мышцы по отношению к повышению внутрисердечного давления. Разрывы происходят в зоне аневризмы или в периинфарктном участке. Причиной смерти при этом является поступление крови в полость перикарда с тампонадой сердца. Поздним осложнением заболевания является постинфарктный синдром, описанный в 1955 г. Дресслером. Он проявляется симптомокомплексом, включающим перикардит, плеврит и пневмонит. В основе формирования этого осложнения лежит аутоиммунизация к некротизированным клеткам миокарда.
Дополнительные методы исследования. В остром периоде инфаркта миокарда в анализе крови отмечается лейкоцитоз со сдвигом
лейкоцитарной формулы влево, анэозинофилия. Несколько позже увеличивается СОЭ. В конце первой недели лейкоцитоз начинает снижаться, а СОЭ к этому времени нарастает, но через 3-4 недели возвращается к норме.
Большое значение придается определению в сыворотке крови активности ряда ферментов, обладающих определенной специфичностью при развитии повреждения сердечной мышцы. Наиболее широко применяется исследование активности креатинфосфокиназы (КФК) и ее МВ-изофермента, аспартатаминотрансферазы (АСТ), лактатдегидрогеназы (ЛДГ). Активность МВ-КФК начинает повышаться через 4-6 часов после начала заболевания, достигает максимума через 16-20 часов и нормализуется через 2-3 суток. Повышение активности КФК отмечается спустя 6-8 часов от начала, принимает максимальное значение через 12-24 часа и нормализуется на 3-4 сутки. Содержание в крови АСТ увеличивается через 8-12 часов, максимума достигает через 24-48 часов и возвращается к норме на 3-7 сутки. Увеличение активности ЛДГ (особенно специфично повышение изоэнзимов ЛДГ 41 и ЛДГ 42) происходит через 8-12 часов, максимальное повышение наблюдается на 3-и сутки и нормализуется через 7-12 дней. Наиболее чувствительным тестом является определение содержания миоглобина, количество которого возрастает уже в течение первого-второго часа, нормализуется через 1-3 суток. Гиперферментемии приобретают диагностическое значение только при сопоставлении с клинической картиной заболевания, так как повышение содержания ферментов может быть связано и с заболеваниями печени, поджелудочной железы и некоторыми другими болезнями.
ЭКГ является одним из основных методов диагностики инфаркта миокарда, позволяющим судить об обширности и локализации повреждения миокарда, о давности процесса, о развитии некоторых осложнений (нарушения ритма и проводимости, аневризма сердца). Зона некроза отражается на ЭКГ изменениями комплекса QRS, зона повреждения - смещением интервала ST, зона ишемии - изменением зубца Т. Главным ЭКГ-признаком некроза является появление глубокого и широкого зубца Q уже через несколько часов после возникновения инфаркта. При обширном трансмуральном некрозе исчезает зубец R и формируется патологический зубец QS. Зона повреждения характеризуется на ЭКГ дугообразным подъемом интервала ST, который сливается с зубцом Т, образуя монофазную кривую (кривую Парди). Зона ишемии проявляется изменениями зубца Т, который может увеличиваться по амплитуде ("коронарный Т"), или становиться отрицательным.
ЭКГ-изменения при трансмуральном поражении подвергаются динамике соответственно стадиям инфаркта миокарда. Подъем сегмента ST в остром периоде сменяется его возвращением к изолинии с инверсией зубца T в подостром. Рубцовый период характеризуется восстановлением положительного зубца T. Сохранение на этой стадии отрицательного зубца T говорит о формировании аневризмы в зоне рубца.
Для переднеперегородочного инфаркта характерны изменения в отведениях V 41,V 42, (V 43,V 44); переднебокового - I, II, aVL,(V 43), V 44, V 45; верхушечного - V 43,V 44; бокового - I, aVL, V 45, V 46; заднего - II, III, aVF.
Эхокардиография выявляет гипо- и акинезию миокарда в инфарктной зоне, снижение фракции выброса, нарушение диастолической функции левого желудочка. Как правило, у больных инфарктом миокарда данные дополнительного обследования подтверждают наличие атеросклероза: выявляются нарушения липидного обмена, снижение амплитуды пульсации аорты при рентгеноскопии, ее удлинение и кальциноз, в случае
предшествующей ангиографии - наличие окклюзий.
Д и а г н о с т и к а. Основанием для постановки диагноза инфаркта миокарда служит сочетание типичной клинической картины заболевания, электрокардиографических симптомов очагового некроза миокарда и лабораторных признаков резорбционно-некротического процесса.
Л е ч е н и е. Организация этапного лечения больных инфарктом миокарда была впервые осуществлена в отечественном здравоохранении (догоспитальный этап, лечение в отделении интенсивной терапии, реабилитация в кардиологической клинике, реабилитация в поликлинических условиях). В острейшем периоде всем больным назначается строгий постельный режим. Диета (N10и по Певзнеру) предусматривает легко усвояемую жидкую и полужидкую пищу (каши, кисели, суфле, яйца всмятку, кефир). Важнейшим мероприятием терапии инфаркта является купирование боли. Наиболее эффективна нейролептаналгезия с применением фентанила и дроперидола. Кроме этого, применяются промедол,
фортрал, дипидолор. Большое значение для исхода заболевания имеет тромболитическая (в острейший период) и антикоагулянтная терапия. Чаще всего в качестве тромболитического средства применяется стрептаза (стрептокиназа), назначение которой целесообразно лишь в сроки до 18-24 часов от начала заболевания (наиболее эффективно в первые 3-4 часа). Гепаринотерапию также следует назначать по возможности рано. Существенное влияние на течение болезни оказывают антиагреганты (ацетилсалициловая кислота, дипиридамол). Учитывая частое развитие нарушений ритма, назначаются антиаритмические препараты (лидокаин, новокаинамид и другие).
В подостром периоде основное внимание уделяется мерам, направленным на улучшение коронарного кровообращения, для чего при-
меняются нитраты пролонгированного действия (нитронг, сустак, эринит, нитросорбит).
Дальнейшая лечебная тактика определяется особенностями течения инфаркта миокарда, наличием осложнений.
Читайте также:

