Диагностика остаточной болезни лейкоза
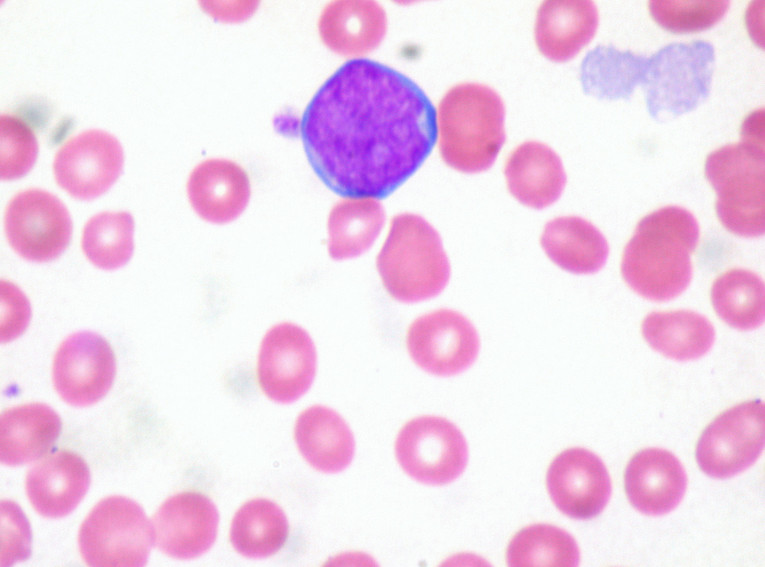
Распознавание лейкемии это довольно сложный процесс. Состоит из нескольких этапов. Сначала необходимо подтвердить наличие злокачественной болезни. Когда будет уверенность в том, что имеет место лейкемия, диагностику необходимо расширить.
Следующим этапом является определение конкретного типа и подтипа лейкемии и формы раковых клеток, из которых она происходит. Это необходимые данные, которые необходимо получить, чтобы начать эффективное лечение.
Симптомы лейкемии
Наиболее тяжелые и быстро нарастающие симптомы возникают в острых лейкозах. В основном, в это время появляются слабость, утомляемость, лихорадка, головная боль, головокружение, боли в костях и суставах, бактериальные и грибковые инфекции полости рта, легких, прямой кишки, а также кровотечения из различных частей тела: носа, слизистых оболочек полости рта, половых путей, желудочно-кишечного тракта.
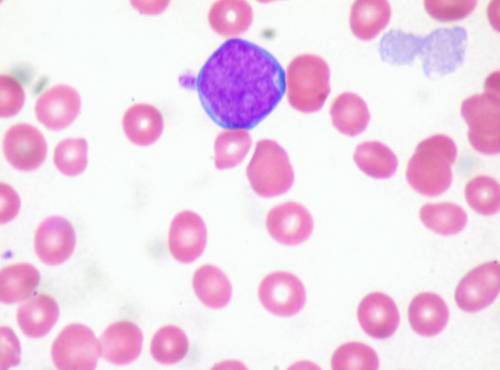
Бласт в периферической крови.
У такого человека, врач во время исследования может почувствовать увеличенные лимфатические узлы, селезенку или печень. В таких случаях, сразу начинается предварительная диагностика лейкемии, так как задержка начала лечения, может быстро привести к смерти.
Случайный диагноз лейкемии
Это странно, но почти половина случаев хронической лейкемии выявляется случайно. Это связано с тем, что симптомы слабо выражены или их вообще нет. Кроме того, если проблемы развиваются медленно, мы к ним привыкаем и не замечают их присутствия. К тому же хронический тип лейкемии чаще встречается у людей старшего возраста, которые свои симптомы связывают со старостью.
К наиболее распространенным симптомам хронической лейкемией относится слабость, утомляемость, головная боль, головокружение, увеличение лимфатических узлов (гораздо чаще, чем при острых), печени, селезенки. В таких случаях, лейкемия выявляется случайно, при контрольных исследованиях крови (морфология).
Общий анализ крови в диагностике лейкемии
При подозрении на лейкемию первыми исследованиями, которые необходимо выполнить являются морфология мазка крови. Клетки крови, должны быть тщательно просмотрены и подсчитаны сотрудниками лаборатории. Составленный предварительный отчет с помощью компьютера не так точен. Компьютер относит клетки к различным группам исключительно на основании их размера, что часто бывает обманчивым. Человек делает это на основании внешнего вида всех элементов клетки.
В зависимости от типа лейкемии в крови происходят различные нарушения.
При острой миелоидной лейкемии наблюдается, как правило, большее количество лейкоцитов, однако нейтрофилов (крупнейшая популяция лейкоцитов) значительно мало. Кроме того, отмечается анемия и тромбоцитопения.
Благодаря исследованию мазка крови можно увидеть, что большинство лейкоцитов это бласты (незрелые клетки), более 20-95% всех лейкоцитов.
При острой лимфобластной лейкемии морфология выглядит немного по-другому. Как правило, обнаруживается очень много лейкоцитов, остальные параметры крови такие же, как и при миелоидной. В мазке обнаруживаются лимфобласты.
Хроническая миелоидная лейкемия имеет очень характерную морфологию. Часто именно на ее основе случайно распознается болезнь.
Всегда обнаруживается большое или очень большое количество лейкоцитов, среди которых преобладают нейтрофилы. В мазке обнаруживается до 10% бластов, происходящих из разных линий развития клеток крови.
Хронический лимфолейкоз определяется большим количеством лимфоцитов. Чаще всего это зрелые лимфоциты B. Очень часто на этом основании при отсутствии каких-либо других симптомов, диагностируют хронический лимфолейкоз. Кроме того, иногда отмечается анемия и тромбоцитопения.
Диагностика лейкемии
Проведение подробной и хорошо структурированной диагностики особенно важно при острых лейкемиях. От появления первых симптомов лейкемии до осуществления лечения остается очень мало времени. Если не лечить острую лейкемию, то уже в течение нескольких недель с момента появления заболевания оно может привести к смерти.
Для диагностики лейкемии (особенно острой) используют следующие методы: общие исследования, необходимые для установления диагноза, дополнительные исследования, а также исследования для определения прогноза заболевания.
Отдельные группы тестов могут сочетаться между собой, так как с помощью одного метода можно, например, определить диагноз и прогноз.
Первые симптомы лейкемии нельзя игнорировать. При возникновении симптомов, указывающих на лейкемию, врач сначала назначает общие исследования. Благодаря им становится понятно, что является ли причиной лейкемия или другая болезнь.
К общим исследованиям относятся, прежде всего, предметное обследование проводимое врачом. Кроме того, выполняется морфология крови, исследование системы свертывания, биохимия крови, общий анализ мочи.
В случае лейкемии, решающие значение имеют специфические отклонения (разные для каждого вида заболевания) в крови. Довольно часто встречаются отклонения в системе свертывания крови. Это заставляет врача расширить диагностику с целью на подтверждения диагноза и определение типа лейкемии и злокачественных клеток.
Обязательны для всех больных с диагнозом лейкоза, полученном при общих исследованиях. Если ранее Вам не сделали морфологию крови вручную (квалифицированный сотрудник лаборатории оценивает клетки крови под микроскопом), это должно быть первым подтверждающим исследованием.
Затем проводятся специализированные исследования. Необходимо проведение биопсии костного мозга. Обычно достаточно менее инвазивной биопсии костного мозга, без загрузки фрагментов кости. Полученный таким образом материал подвергается дальнейшим исследованиям: иммунофенотип, цитогенетические и молекулярные исследования.
В повседневной клинической практике прогноз человека на выздоровление оценивается на основе общих и подтверждающих исследований и оценке общего состояния. Одним словом, для того, чтобы получить отнести пациента к группе риска, необходимо объединить результаты лабораторных исследований с клиническими симптомами и медицинским обследованием.
Это группа исследований, предназначенных для оценки общего состояния больного. С их помощью проверяет, как работают отдельные органы и нет ли других сопутствующих заболеваний, не связанных с лейкозом. Другие хронические заболевания, такие как ВИЧ или вирусный гепатит, могут затруднить лечение лейкемии.
Все инфекции у больных лейкемией, протекают тяжелее и их необходимо сразу же лечить сильными средствами. Кроме того, у женщин, всегда нужно выполнить тест на беременность. Беременность оказывает существенное влияние на выбор терапии.
Лейкоз – онкологический процесс, нарушающий работу кроветворной системы, при котором деформируются и видоизменяются клетки крови. Количество незрелых лимфоцитов беспорядочно увеличивается. Продуцируемые атипичные клетки распространяются по кровотоку и провоцируют рост метастазов в любых органах тела. Накапливаясь в костном мозге, они постепенно заменяют здоровые клетки. Нарушается баланс лейкоцитов, тромбоцитов и эритроцитов. Для выявления диагноза используют комплексный подход. Проблемой занимаются онкогематологи.
Заболевание, при котором нарушен кроветворный процесс, делится на ряд видов. Лейкозы возникают из определённых клеток и формируют новообразования.
- Лимфобластная лейкемия протекает в острой форме. Кровь наполняют повреждённые лейкоциты. Рак лимфобластного типа чаще встречается у детей младшего возраста. Главный симптом заболевания – частые инфекционные болезни с высыпаниями на кожных покровах. При этом ребёнок вялый, отказывается от еды, возникают частые кровотечения, образуются кровоподтеки на теле. При подтверждении диагноза начинается незамедлительное лечение, способное побороть злокачественный процесс.
- Лимфобластный лейкоз имеет хронический характер. Развивается медленно, без ярко выраженных симптомов. Обычно диагностируется у взрослых старше 60 лет. Преимущественно у представителей сильного пола.
- При лейкозе миелобластного типа наблюдается острое течение болезни. Незрелые миелоидные клетки обнаруживаются в крови и костном мозге. Болезнь поражает взрослое население. Характерны симптомы инфекционных заболеваний разного генеза.
- Миелолейкоз выступает в качестве подтверждения диагноза. Хроническая патология медленно развивается и обычно обнаруживается при диагностике других заболеваний.
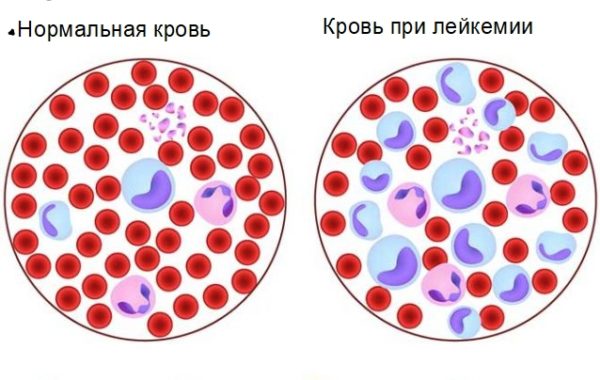
Хроническую стадию разделяют на 2 вида:
- Доброкачественный лейкоз диагностируется при наличии одного клона атипичной клетки.
- Для злокачественной формы характерно наличие вторичных клонов. Болезнь стремительно развивается с бесконтрольным делением бластов.
Причины возникновения болезни
Главная причина – аномальные процессы в кроветворящих органах, в частности в костном мозге. Развиваются на фоне аутоиммунных заболеваний, генетических нарушений на стадии формирования плода и под действием различных внешних факторов:
- Плохая экологическая обстановка;
- Вредные привычки;
- Вирусные поражения организма;
- Контакт с радиационным и ультрафиолетовым излучением.
Группа риска состоит из пожилых людей, больных с иммунодефицитом и хроническими воспалительными процессами в организме.
Методы лабораторной диагностики
Лейкемия признана опасным злокачественным заболеванием, требующим особого лечения. Из-за отсутствия ярких симптомов на первых стадиях болезни люди путают лейкозы с доброкачественными процессами. К примеру, частые простудные заболевания начинают пугать больного только после длительного времени развития болезни, усиления симптомов и при отсутствии положительной реакции на терапевтическое лечение. Если терапевт отмечает нарушения, свойственные болезням костного мозга, пациент направляется на консультацию и дальнейшее лечение к онкологу.

Лабораторные исследования назначают в начале определения проблемы. При результатах, отклоненных от нормы, наблюдается увеличение несозревших клеток. Их количество превышает 30%, эритроцитарные ростки занимают больше 50%. В костном мозге отмечаются атипичные промиелоциты.
Для диагностики уровня лейкоцитов, эритроцитов и тромбоцитов исследуют клинический анализ крови. Повышенный уровень лейкоцитов и снижение количества других клеток позволяют распознать рак на ранней стадии. При исследовании периферической крови обнаруживается нейтро- и тромбоцитопения, лимфоцитоз, азурофильные гранулы, нормохромная анемия и зрелые бласты с отсутствующим промежуточным созреванием.
- Для лейкоза характерно значительное снижение уровня гемоглобина. При этом больной исключает менструальные, обильные носовые кровотечения, потерю крови при хирургическом вмешательстве в ближайшее время. При онкологии гемоглобин падает в 2 раза. Показатель снижается при острой форме болезни.
- Отмечается снижение ретикулоцитов.
- Лимфоцитарная формула представлена серьёзными нарушениями. В зависимости от стадии рака, уровень лимфоцитов снижается и повышается.
- Врачи обращают внимание на скорость оседания эритроцитов (СОЭ). При онкологии она значительно увеличена.
- В формуле крови отсутствуют базофилы и эозинофилы.
- Если в крови отсутствуют переходные клетки, а формула представлена только большим количеством молодых и малым количеством зрелых форм, обнаруживается лейкемический провал.
Совокупность нескольких признаков требует консультации гематолога. Если изменён один показатель в формуле крови, развитие онкологического процесса сводится к нулю.
Биохимия крови выявляет состояние и работоспособность внутренних органов под влиянием онкологического процесса.
При подозрении на лейкоз острой или хронической формы диагностика расширяется:
- Важно диагностировать степень злокачественности рака. Дифференциальная особенность клетки говорит о её природе и агрессивности. Эти особенности можно выявить с помощью гистологического исследования биоматериала.
- Костный мозг подвергается пункции с помощью иглы, введенной в полость кости. Обычно для биопсии выбирается грудная клетка. Исследование показывает наличие острого или хронического процесса. По анализу можно определить цитогенетический и морфологический вид болезни. С помощью данной процедуры выполняется проверка реакции пораженной клетки на химиопрепарат.
- Миеломограмма обнаруживает соотношение атипичных клеток с нормальными. Обследование показывает степень пораженности организма. У здорового человека бластные клетки не должны превышать 5%. Исследуемый материал представлен образцом костного мозга. Во время процедуры обнаруживаются лимфоцитоз и природа атипичных клеток. Отсутствуют мегакариоциты. Этот способ признан наиболее точным для постановки диагноза.
- Цитохимическая лабораторная диагностика основана на определении специфических ферментов. Метод незаменим при определении острых форм заболевания и прогнозировании их течения.
- Для диагностики острого лимфо- и миелобластного лейкоза проводят иммунофенотипирование. Тактика лечения этих видов лейкоза различна, поэтому важно уточнить диагноз.
- Необходимо исследовать ликвор (спинномозговую жидкость) для выявления повышенного количества клеток (цитоза).
Диагностика лейкоза включает ряд инструментальных методов. Они не уступают по информативности лабораторным. Чтобы провериться на рак крови, пациент проходит следующие исследования:
- При помощи компьютерной томографии выявляются повреждения сосудов и метастазы в лимфатических узлах. Метод используется для масштабной диагностики организма путём послойного сканирования.
- Рентгенография грудной клетки назначается при характерных симптомах повреждения лёгких: регулярном кашле, отделении мокроты с включениями крови, боли в груди.
- Если онкологический процесс поразил головной мозг, рекомендовано проведение магнитно-резонансной томографии. Для болезни характерны симптомы: ухудшение зрения, онемение конечностей, нарушения памяти и сознания, головокружения и обмороки.
- Для выявления отклонений в работе сердечной мышцы проводят электрокардиограмму и эхокардиограмму.
- Диф диагностика основана на исключении возможных патологий с такими же симптомами, как при лейкозе. Исследование проводится с помощью компьютерных программ. Лейкемия схожа по симптоматике со следующими заболеваниями:

- Мононуклеоз инфекционного генеза провоцирует увеличение селезёнки. Увеличивается температура тела. В крови присутствуют недоразвитые лимфоциты. Эти же показатели встречаются при ангине и желтухе.
- ВИЧ не является онкологической болезнью, но тоже снижает иммунитет до 0. Человек страдает от частых инфекционных заболеваний. Наблюдается лимфаденопатия. Специальный анализ крови исключает вариант развития рака.
- При поражении человека токсичными веществами развивается апластическая анемия. Клетки костного мозга заменяются жировой тканью. Развивается панцитопения.
- Снижение количества всех клеток крови происходит после операций на органах желудочно-кишечного тракта.
Современные методы исследования распознают рак на каждом этапе развития. Для благоприятного исхода необходимо обращаться за медицинской помощью при любых нарушениях здоровья. Система кроветворения выполняет жизненно важную функцию, позволяющую людям противостоять болезнетворным бактериям.
Результаты исследований предоставляют возможность подобрать индивидуальное эффективное лечение. Обычно с раком крови борется химиотерапия. Для определённой разновидности лейкоза онкологи используют различные медикаменты.
При отдельных патологических процессах применяют трансплантацию костного мозга. Кроветворный процесс перезапускается, и пациент входит в стойкую ремиссию.
Е.В. Флейшман
Российский онкологический научный центр им. Н.Н. Блохина РАМН, Москва
За последние годы улучшились результаты лечения злокачественных опухолей и, в частности, гемобластозов. Важная роль в усовершенствовании терапевтических подходов принадлежит современным методам цитогенетического и молекулярно-генетического анализа. Однако, к сожалению, значительное число пациентов все еще погибает от рецидивов или метастазов.
Для дальнейшего повышения эффективности терапии необходимо иметь четкие критерии раннего предсказания рецидива. Весьма обнадеживающие результаты дает мониторинг течения болезни с использованием метода полимеразной цепной реакции (ПЦР, PCR), обладающего высокой чувствительностью и позволяющего обнаруживать неопластические клетки в крови даже тогда, когда количество их весьма невысоко и не превышает 1х103 или 1х106.
Метод PCR с большим успехом используется в гематологической практике уже около 10 лет. В частности, RT-PCR (полимеразная цепная реакция с обратной транскрипцией) позволяет выявлять отдельные лейкозные клетки, персистирующие во время ремиссии, то есть, дает возможность проводить мониторинг так называемой минимальной резидуальной болезни (МРД). Это очень важно для детекции и количественного учета химерных генов, образовавшихся в результате специфических хромосомных транслокаций или инверсий.
Весьма впечатляющие результаты получены за последние 10-15 лет при молекулярно-генетическом мониторинге острого миелобластного лейкоза (ОМЛ). Этим результатам и посвящено настоящее сообщение.
Известно, что для большинства клинико-морфологических типов гемобластозов характерны неслучайные изменения кариотипа, чаще всего хромосомные транслокации, приводящие к формированию химерных генов.
Показано, что в тех случаях ОМЛ, где лейкозные клетки характеризуются наличием специфических химерных генов и, соответственно, их химерных продуктов (транскриптов химерных генов), достижение терапевтической ремиссии сопровождается значительным снижением уровня химерного транскрипта в крови и костном мозге больных, нередко вплоть до полного исчезновения: наступает так называемая молекулярная ремиссия. Показано также, что на любом этапе гематологической ремиссии может наблюдаться резкое повышение содержания химерного транскрипта в крови или костном мозге больного, то есть, возникает молекулярный рецидив. Вслед за этим обязательно следует гематологический рецидив, как правило, 4-6 месяцев спустя. Обще признано, что применение молекулярно-генетических методик создает возможность значительно более ранней диагностики рецидива, чем стандартные клинико-лабораторные тесты.
Достигнутые в последние годы успехи в лечении ОМЛ в значительной мере обусловлены подбором терапевтических протоколов в соответствии с результатами хромосомного анализа на момент постановки диагноза. В основе этого подхода лежит вывод о том, что кариотип лейкемических клеток представляет собою важнейший прогностический признак (Arthur et al.;1989; Mrozek et al., 1997). Выделяют три группы хромосомных аномалий, определяющих прогноз: неблагоприятный, промежуточный и относительно благоприятный. Безрецидивная пятилетняя выживаемость в этих группах сильно различается: так в первой группе она составляет 5-15%, а в третьей — 35-70% (Grimwade et al., 1998; . Buchner et al., 1996).
Следует отметить, что новые терапевтические протоколы значительно улучшили продолжительность жизни больных в группе с благоприятным прогнозом, но не изменили этот показатель в группе с неблагоприятным прогнозом.
Прогностически благоприятными являются транслокации t(8;21)(q22;q22) и t(15;17)(q22;q21), а также инверсия inv(16)(p13;q22) (Dastugue et al., 1995; Grimwade et al., 1998).
Транслокация t(8;21) — одна из наиболее частых специфических транслокаций, ее обнаруживают примерно у 20% взрослых и у 40% детей с М2 (FAB классификация) вариантом ОМЛ. В результате этой транслокации происходит образование химерного гена при соединении фрагментов двух разных генов: АМL1, расположенного на хромосоме 21, и ЕТО (MTG8), расположенного на хромосоме 8. Химерный транскрипт АМL1-ЕТО удается определить с помощью PCR практически у всех больных с транслокацией (8;21) в момент постановки диагноза. Транслокация может быть скрытой, не видимой при стандартном цитогенетическом исследовании, но она обязательно выявляется с помощью флюоресцентной гибридизации in situ (FISH) и/или PCR (Palisgaard et al. 1998). У многих больных химерный транскрипт удавалось обнаруживать в течение длительной (несколько лет) гематологической ремиссии. Был сделан вывод о том, что PCR не подходит для мониторинга ОМЛ с транслокацией (8;21). Недавно был разработан метод количественной PCR, который позволяет поставить диагноз молекулярного рецидива и предсказать гематологический рецидив по повышению уровня транскрипта.
Транслокация t(15;17)(q22;q21) и соответствующие химерные гены PML-RARA и RARA-PML строго специфичны для острого промиелоцитарного лейкоза (ОПЛ, М3). Лейкоз с транслокацией t(15;17) обладает уникальной чувствительностью к дифференцирующему агенту — АТРА. Применение названного агента, особенно в комбинации с химиотерапией, существенно улучшило результаты лечения ОПЛ: в 70-90% случаев удается достигнуть многолетней ремиссии, вплоть до полного излечения. Следовательно, обнаружение транслокации t(15;17) на цитогенетическом или молекулярном уровне имеет решающее значение для выбора терапии. Достижение полной ремиссии при ОПЛ сопровождается исчезновением химерного транскрипта, если же его удается вновь обнаружить, то это обычно предвещает рецидив (Hascovec et al., 1998). В литературе опубликованы два случая успешного предотвращения гематологического рецидива ОПЛ после интенсификации лечения в начале молекулярного рецидива (LoCoco et al., 1998).
В группу хромосомных аномалий, определяющих относительно благоприятный прогноз при ОМЛ, входит также инверсия inv(16)(p13q22) и транслокация t(16;16)(p13;q22), приводящие к образованию химерного гена CBFbeta-MYH11. Эти аномалии патогномоничны для своеобразной формы ОМЛ — М4Ео и, кроме того, наблюдаются в 40% случаев ОМЛ-М4. Существует строгая корреляция между наличием атипичных эозинофилов и присутствием инверсии16. При стандартном цитогенетическом исследовании эту хромосомную аномалию удается обнаружить лишь на препаратах очень высокого качества, в то же время, использование FISH и PCR выявляет ее безотказно. У большинства больных с inv(16) гематологическая ремиссия, полученная в результате лечения, сопровождается несколько отсроченной молекулярной ремиссией. Повторное появление характерного гибридного транскрипта предвещает неизбежный рецидив (Laczika et al.,1998).
В РОНЦ РАМН начата работа по молекулярно-цитогенетическому мониторингу при ОМЛ, протекающем с хромосомными аномалиями, предвещающими хороший ответ на терапию. При постановке диагноза в каждом случае определяется стартовый уровень химерного транскрипта, характерного для транслокации, установленной при цитогенетическом исследовании. В стадии индукции ремиссии определяется кривая падения уровня транскрипта в костном мозге и в крови под влиянием лечения. Исследование предпринято с целью получения ответов на следующие вопросы:
1) какой интервал времени между началом лечения и началом ремиссии свидетельствует о возможном раннем рецидиве?
2) какой уровень экспрессии химерного транскрипта свидетельствует о приближении рецидива в период ремиссии?
3) какой уровень экспрессии химерного гена предсказывает поздний рецидив?
4) существует ли возможность предотвратить гематологический рецидив и, тем самым, продлить ремиссию и продолжительность жизни больного, интенсифицировав терапию во время молекулярного рецидива?
Проводимая работа важна для оценки клинического значения мониторинга МРД при миелобластном лейкозе и, в частности, для улучшения результатов лечения путем изменения протокола при признаках молекулярного рецидива.
1. Arthur D, Berger R, Golomb HM, Swansbury GJ, Bloomfield CD, de la Chapelle A, Dewald GW, Garson OM, Hagemejer A, Kaneko Y, Mitelman F, Pierre RW, Ruutu T, Sakurai M, Lawler SD and Rowley JD. Cancer Genet Cytogenet. I989, 40: 203-216.
2. Buchner T, Heineke A. Leukemia 1996,10 Suppl, 1: 28-29.
3. Dastugue N, Payen C, Lafage-Pochitaloff M, Bernard P, Leroux D, Huguet-Rigal F, Stoppa A-M, Marit G, Molina L, Michallet M, Maraninchi D, Attal M and Refers. J Leukemia 1995, 9: 1491-1498.
4. Grimwade D, Gorman P, Duprez E, Howe K, Langabeer S, Oliver F, Walker H, Culligan D, Waters J, Pompert M, Goldstone A, Burnett A, Freemont P, Sheer D, Solomon E. Blood 1997, 90: 4876-4875.
5. Grimwade D, Walker H, Oliver F, Wheatley K, Harrison C, Harrison G, Rees J, Hann I, Stevens R, Burnett A, Goldstone A. Blood 1998, 92: 2322-2333.
6. Hascovec C, Polak J, Pechova R, Lemez P, Zemanova Z, Penka M, Zak P, Schwarz J. Brit J Haematol. 1998, 102: 100.
7. LoCoco F, Diverio D, Petti MC, Avvisati G, Biondi A, Meloni G, Mandelli F. Brit J Haematol. 1998: 102:149.
8. Mrozek K, Heinonen K, de la Chapelle A, Bloomfield C. Semin in Oncol 1997, 24:17-31.
9. Palisgaard N, Hokland P, Riishoj DC, Bedersen B and Jorgensen P. Blood 1998, 92: 574-588.
Проведение молекулярных генетических исследований для оценки минимальной остаточной болезни (МОБ) и течения лейкозов как этап лечения гематологического больного. Значение величины МОБ, ее определение для стратификации риска и прогноза развития рецидива.
| Рубрика | Медицина |
| Вид | статья |
| Язык | русский |
| Дата добавления | 11.09.2013 |
| Размер файла | 15,6 K |
- посмотреть текст работы
- скачать работу можно здесь
- полная информация о работе
- весь список подобных работ
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Результаты лечения острых лейкозов и минимальная остаточная болезнь (предварительные данные)
С изобретением полимеразной цепной реакции (ПЦР) онкогематология получила возможность использовать этот значительно более чувствительный метод для выявления в больших группах больных специфических и неспецифических генетических транслокаций в опухолевых клетках, для прогнозирования течения заболевания, а также для мониторинга минимальной остаточной болезни (МОБ) в процессе лечения. Тем более, что открыты криптические транслокации, не определяемые цитогенетическим методом.
МОБ - это персистевция остаточного пула лейкемических клеток после достижения ремиссии лейкоза. Определение МОБ важно для стратификации риска и прогноза развития рецидива заболевания до клинической и гематологической манифестации.
Величину МОБ выражают в количестве нормализованных копий химерного транскрипта (NCN) в исследуемом образце костного мозга/периферической крови. Оценивают их в процентах относительно копий транскрипта в образце на момент дебюта заболевания и в десятичных логарифмах от этого процента.
Значение величины МОБ:
При остром промиелоцитарном лейкозе (ОПЛ, маркер - химерный ген PML-RARa), по данным зарубежных исследователей [3]:
- считают, что количество NCN после курса индукционной терапии и кинетика снижения от момента диагностики, то есть величина логарифма, не коррелируют с исходом;
- отмечают корреляцию между риском рецидива и положительным молекулярным результатом после курса консолидации;
- положительный молекулярный результат во время поддерживающей терапии и перед окончанием лечения ассоциирован с высоким риском рецидива и короткой выживаемостью. Рекомендуют оценивать МОБ каждые 3 месяца во время лечения и после лечения в течение двух лет с интервалом 4-5 месяцев.
При остром лимфобластном лейкозе (ОЛЛ) с t (9;22) и при остром миелобластном лейкозе (ОМЛ) с t (8;21), наоборот, кинетика снижения количества транскрипта после индукционной терапии имеет значение - индукционную терапию считают успешной, если она обеспечивает снижение уровня транскрипта на 3 Ig и более (т.е. в 1000 раз). Это рассматривают как предиктор отсутствия рецидива. Дальнейшее снижение на 2-3 Ig после консолидации также важно для исхода [3].
В целом, для ОМЛ снижение количества химерного транскрипта минимум на 2 Ig после фазы индукции считают необходимым условием для длительной ремиссии. Появление положительного молекулярного результата рассматривают как предвестник рецидива [2].
Однако у более 50 % больных ОМЛ специфический молекулярный маркер отсутствует. Б таких случаях для оценки МОБ может быть полезным определение уровня экспрессии гена Wilms tumor - WTl.
TeHWTl впервые был идентифицирован как локализованный на 11 хромосоме (11р13) ген, ответственный за неоплазию почек у детей. Ген WTl кодирует транскрипционный фактор, влияющий на экспрессию целого ряда факторов роста и их рецепторов. Показана гиперэкспрессия WTl более чем в 90 % случаев ОМЛ, а также при ОЛЛ и миелодиспластических синдромах. Конкретная роль в гемопоэзе и лейкомогенезе остается до конца не изученной [1].
минимальная остаточная болезнь лейкоз
Целью исследования является внедрение результатов ПЦР для определения особенностей течения острых лейкозов, определения прогноза и мониторинга МОБ в процессе химиотерапии.
Актуальность. Только в гематологическом отделении ЧОКБ ежегодно регистрируются и начинают полихимиотерапию 35-40 новых пациентов с острыми лейкозами, средний возраст которых 42 года (15-71 год).
Материалом служил костный мозг пациентов из гематологического отделения ЧОКБ. Оценку уровня экспрессии генов методом количественной ПЦР в режиме реального времени проводят в лаборатории йммунотипирования тканей Челябинской областной станции переливания крови. Данные исследования осуществляются с использованием протоколов и рекомендаций европейской кооперативной группы "А Europe Against Cancer".
Результаты. Предварительному анализу подвергнуты только случаи острого лейкоза, которым проведено молекулярно-генетическое исследование. Анализ проведен на 1 января 2008 г.
Транс локация (15;17) была обнаружена у 8 пациентов с ОПЛ, Это - случаи впервые объективно подтвержденного диагноза ОПЛ в Челябинской области. Во время химиотерапии два пациента погибли в период индуцирующей ремиссию химиотерапии. Еще один пациент погиб от геморрагических осложнений во время консолидации ремиссии, находясь в молекулярной ремиссии ОПЛ. Пять пациентов живы и сохраняют первую молекулярную ремиссию сроками 22,18,10,5,5 мес. Уровень МОБ снизился со 100 % до 0, а средний уровень экспрессии WTl - с 1050 до 2,7.
Транс локацня (9;22) обнаружена у 6 пациентов с ОЛЛ и 1 пациента с ОМЛ. Является абсолютно неблагоприятным прогностическим признаком. Выявляется у 25 % взрослых больных с ОЛЛ и у 1-2 % взрослых с ОМЛ. Во время химиотерапии 2 пациента умерли на этапе достижения ремиссии от осложнений, у 1 пациента индукционное лечение с добавлением Гливека привело к клинико-гематологической ремиссии продолжительностью 6 месяцев. Один пациент с гематологической ремиссией 4 месяца направлен на трансплантацию костного мозга, представляющую единственный шанс на спасение. Еще двое пациентов получают индукционную химиотерапию в настоящее время. Во всех случаях молекулярная ремиссия не была достигнута. Показательна судьба пациента с ОМЛ: в результате проведения полихимиотерапии была достигнута гематологическая ремиссия CO снижением уровня МОБ CO 100 % до 2,9 %. Консолидация высокодозной полихимиотерапией не привела к молекулярной ремиссии. В течение двух месяцев уровень МОБ увеличился в 10 раз (34 %), что позволило прогнозировать рецидив заболевания в ближайшее время. Проведение аллогенной родственной трансплантации гемопоэтических стволовых клеток привело к молекулярной ремиссии, что, как мы надеемся, должно соответствовать благоприятному прогнозу.
Транслокация (4;11) обнаружена у трех пациентов в дебюте ОЛЛ Является также абсолютно неблагоприятным прогностическим признаком. Все случаи характеризовались большой опухолевой массой (гиперлейкоцитоз, гепатоспленомегалия, лимфаденопатия) и отсутствием ремиссии даже при высокодозной химиотерапии.
Транслокация (8;21) обнаружена в дебюте OMJI у пяти пациентов. Предполагает благоприятный прогноз заболевания. Во время химиотерапии 1 пациент погиб во время индукционной химиотерапии от ее осложнений. У 1 пациента поломка выявлена при первом рецидиве ОМЛ. Достигнута вторая гематологическая ремиссия продолжительностью 21 месяц. Два пациента сохраняют первую ремиссию ОМЛ сроками 26 и 15 месяцев. У всех трех живых пациентов этой группы сохраняется химерный ген AMLWBTO.
Еще одному пациенту из этой группы проведенная в период гематологической ремиссии высокодозная химиотерапия не привела к молекулярной ремиссии острого лейкоза, но была достигнута после проведения аллогенной неродственной трансплантации гемопоэтических стволовых клеток в Санкт-Петербурге, что ассоциируется с благоприятным прогнозом.
Вывод. Проведение молекулярных генетических исследований для оценки МОБ и особенностей течения лейкозов должно стать необходимым этапом лечения гематологического больного.
Список литературы
1. Keilholz, U. Wilms' tumour gene I (WTl) in human neoplasia I U. Keilholz [et al.] // Leukemia. 2005. № 19. P.1318-1323.
2. Raanani, P. Detection of Minimal Residual Disease in Acute Myelogenous Leukemia / P. Raanani, I Ben-Bassat // Acta Haematologica. 2004. № 112. P.40-54.
3. Santamaria, S. Usmg quantification of the PML-RARa transcript to stratify the risk of relapse in patients with acute promyelocytic leukemia / S. Santamaria [et al,] // Haematologica. 2007. №92. P.315-322.
Размещено на Allbest.ru
Лейкоз (лейкемия, белокровие) — клональное злокачественное заболевание кроветворной системы. Классификация лейкозов, этиологические факторы, течение болезни. Клиника и группы риска острых лейкозов, морфологические особенности, диагностика и лечение.
презентация [4,0 M], добавлен 14.02.2014
Анамнез жизни и заболевания, механизм развития заболевания. Паспортные данные и жалобы больного на момент курации. Диагностика гипертонической болезни. Составление плана обследования пациента. Данные лабораторных исследований. Назначение курса лечения.
история болезни [19,2 K], добавлен 31.10.2013
Современные взгляды на этиологию, клиническую картину, терапию лейкозов у детей. Клиническая картина заболевания. Диагностика лейкозов у детей, принципы лечения. Деятельность медицинской сестры. Примеры реализации сестринского процесса в ряде случаев.
дипломная работа [1,7 M], добавлен 01.08.2016
Основные причины возникновения поликистозной болезни почек. Характеристика пищеварительной и сердечно-сосудистой систем больного. Состояние жизненноважных органов и систем. Данные лабораторных и инструментальных исследований. Способы лечения заболевания.
история болезни [64,9 K], добавлен 17.04.2012
Жалобы больного при поступлении на лечение. Результаты обследования органов пациента, данные лабораторных исследований. Постановка диагноза: хронический гастрит (обострение). План лечения: диета, прием медицинских препаратов. Профилактика рецидива.
история болезни [44,5 K], добавлен 13.01.2015
Описание жалоб пациента, общего анамнеза болезни. Данные врачебного осмотра, клинических лабораторных исследований. Дифференциальная диагностика, вынесение диагноза гипертонической болезни III ст. Степень развития осложнений. Разработка плана лечения.
история болезни [11,1 K], добавлен 01.10.2013
Анамнез больного и установление диагноза ишемическая болезнь сердца, стенокардия. Обследование сердечно-сосудистой системы больного и проведение лабораторных исследований. Разработка плана лечения. Ухудшение состояния и перевод больного в реанимацию.
история болезни [25,4 K], добавлен 11.02.2015
Определение понятия "лейкоз". Основными причинами смерти больных, страдающих лейкозами, классификация и особенности лейкозов. Этиология и патогенез лейкозов. Тип патологических процессов, сходных по картине крови с лейкозами. Лейкемоидные реакции.
реферат [32,8 K], добавлен 03.06.2019
Анализ жалоб больного, история настоящего заболевания и жизни пациента. Результаты осмотра больного, состояние основных систем органов. Диагноз, его обоснование и план дополнительного обследования. Особенности способов лечения мочекаменной болезни.
история болезни [24,4 K], добавлен 24.12.2010
Анализ состояния основных систем организма. Жалобы больного при поступлении на лечение. Обследование органов, данные лабораторных исследований. Постановка диагноза: гипертоническая болезнь сердца, стенокардия напряжения. План терапевтического лечения.
история болезни [42,8 K], добавлен 16.11.2014

- главная
- рубрики
- по алфавиту
- вернуться в начало страницы
- вернуться к началу текста
- вернуться к подобным работам
- Рубрики
- По алфавиту
- Закачать файл
- Заказать работу
- Вебмастеру
- Продать
- весь список подобных работ
- скачать работу можно здесь
- сколько стоит заказать работу?
Работы в архивах красиво оформлены согласно требованиям ВУЗов и содержат рисунки, диаграммы, формулы и т.д.
PPT, PPTX и PDF-файлы представлены только в архивах.
Рекомендуем скачать работу.
Читайте также:

